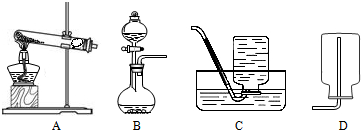
解:(1)制取氧气有多种方法,如分解过氧化氢溶液、加热高锰酸钾、加热氯酸钾、电解水等等.
(2)①过氧化氢分解生成水和氧气,故产物无污染,所以正确;
②过氧化氢在有催化剂的条件下,不需加热就能分解生成氧气,可节约能源,所以正确;
③过氧化氢分解反应不需加热,所以错误;
④过氧化氢分解生成水和氧气,所以错误.
(3)排水法收集氧气是利用氧气不易溶于水,通入后可把水排出,排出水的体积就是收集到的氧气的体积,所以确定某集气瓶最多可收集氧气的体积,可先向集气瓶中盛满水,再用量筒量出集气瓶中水的体积即可.
(4)分解过氧化氢溶液的方法制氧气是固体与液体混合后反应,条件是常温,气体发生装置选择C,氧气不易溶解于水,可用排水法收集,氧气的密度比空气大,也可用向上排空气法收集,装置可选D或E;过氧化氢要迅速分解,要用催化剂,一般是选二氧化锰.
(5)高锰酸钾加热易变为纤细粉末,会随气流进入并堵塞导管,在该装置试管内的导管口处添加了一团棉花,是为了防止加热时高锰酸钾粉末进入导管.
(6)实践是检验真理的唯一标准,判断一种观点是否正确,要依据实验事实.
(7)①根据质量守恒定律,反应前后原子的种类和数目不变,每个X中含有两个氢原子和一个氧原子,为水,化学式为:H
2O.
②实验室常用氯化铵固体与碱石灰固体共热来制取氨气,反应物为固体,条件是加热,气体发生装置选A;氨气极易溶于水,不能用排水法收集,其密度比空气小,必须用向下排空气法收集,装置选B.
故答案为:
(1)加热氯酸钾(或电解水)(其它合理答案也可);
(2)①②;
(3)先向集气瓶中盛满水,再用量筒量出集气瓶中水的体积即可(其它合理答案也可);
(4)C、D(或C、E);MnO
2(其它合理答案也可);加快化学反应速率(或催化作用);
(5)防止加热时高锰酸钾粉末进入导管;2KMnO
4
K
2MnO
4+MnO
2+O
2↑;
(6)③;
(7)①H
2O;②A;B.
分析:(1)根据能生成氧气的反应种类回答.
(2)从节约能源、环境保护、操作方便、二氧化锰的回收等方面分析分解过氧化氢溶液制氧气的优点,对照选项做出选择.
(3)根据排水集气法的原理回答.
(4)根据用分解过氧化氢溶液的方法制取氧气的药品状态、反应条件及氧气的性质回答.
(5)根据高锰酸钾受热易形成纤细粉末的特点回答前一空;根据实验室用高锰酸钾制取氧气的原理书写方程式.
(6)根据实践是检验真理的唯一标准观点回答.
(7)①根据质量守恒定律判断.
②实验室用氯化铵固体与碱石灰固体共热来制取氨气时所用药品的状态和反应条件,以及氨气的溶解性和密度回答.
点评:气体的制取是初中重要的化学实验之一,既是难重点,又是考查热点,理解反应原理,掌握装置的选择依据、气体的检验、验满、收集方法,了解实验步骤和注意事项是解决该类问题的关键.


 CaCl2+2NH3↑+2X.X的化学式为:________.
CaCl2+2NH3↑+2X.X的化学式为:________. K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;