
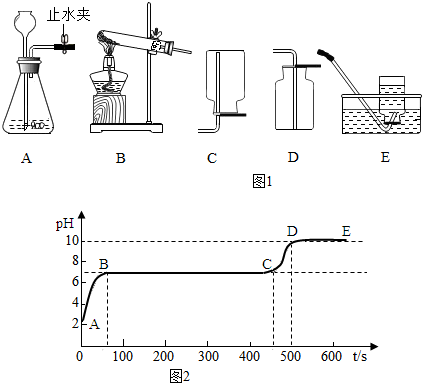
分析 (1)实验室用A、E的组合来制取氧气,由发生装置A可以看出反应不需加热,故只能用过氧化氢溶液和二氧化锰来制取;
(2)若用B、D装置制取氧气,由B装置可知是加热固体制取气体,且试管口有棉花团,故所选药品为高锰酸钾;检查气密性,先把导管浸入水中,用手紧握试管,观察水中的管口有没有气泡冒出;如果有气泡冒出,说明装置不漏气.检验氧气是否集满的方法是利用氧气的助燃性,用带火星的木条放在集气瓶口,如果复燃,证明集气瓶内已充满氧气;
(3)测得其残留液pH等于2,说明盐酸有剩余.根据图象可知,AB段的pH越来越大,先是石灰石与稀盐酸反应生成氯化钙和水和二氧化碳,由于碳酸钠溶液呈碱性,故随着碳酸钠溶液的增加pH越来越大,BC段此时是氯化钙和碳酸钠反应生成碳酸钙白色沉淀和氯化钠,CD段是碳酸钠过量,碳酸钠溶液呈碱性.
解答 解:(1)实验室用A、E的组合来制取氧气,由发生装置A可以看出反应不需加热,故只能用过氧化氢溶液和二氧化锰来制取,过氧化氢溶液和二氧化锰反应生成水和氧气,故化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)若用B、D装置制取氧气,由B装置可知是加热固体制取气体,且试管口有棉花团,故所选药品为高锰酸钾;用加热高锰酸钾的方法制取氧气,在生成氧气的同时,还有锰酸钾和二氧化锰生成,所以化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;检查气密性,先把导管浸入水中,用手紧握试管,观察水中的管口有没有气泡冒出;如果有气泡冒出,说明装置不漏气.由于氧气的密度比空气大,进入集气瓶后,沉积在集气瓶的底部,氧气自下而上,充满集气瓶,当瓶口有氧气时,说明氧气已收集满,检验氧气是否集满的方法是利用氧气的助燃性,用带火星的木条放在集气瓶口,如果复燃,证明集气瓶内已充满氧气;
(3)测得其残留液pH等于2,说明盐酸有剩余.根据图象可知,AB段的pH越来越大,先是石灰石与稀盐酸反应生成氯化钙和水和二氧化碳,其反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;随着碳酸钠的增加,由于碳酸钠溶液呈碱性,故随着碳酸钠溶液的增加pH越来越大,说明是盐酸与碳酸钠反应生成氯化钠、水和二氧化碳,其反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,当二者恰好完全反应时,溶液的pH不再变化,即BC段,此时是氯化钙和碳酸钠反应生成碳酸钙白色沉淀和氯化钠,其反应的化学方程式为:CaCl2+Na2CO3═CaCO3↓+2NaCl;因此溶液呈中性;当氯化钙和碳酸钠完全反应时,随着碳酸钠的增加,溶液的pH越来越大,故CD段是碳酸钠过量,碳酸钠溶液呈碱性.
故答案为:①CaCO3+2HCl═CaCl2+H2O+CO2↑ Na2CO3+2HCl=2NaCl+H2O+CO2↑
②CaCl2+Na2CO3═CaCO3↓+2NaCl;
③碳酸钠溶液显碱性且碳酸钠溶液过量.
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和溶液PH的变化等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
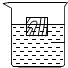 一只盛有稀硫酸的烧杯中,漂浮着一块木块(如图),往烧杯加入适量某种固体物质后,木块浸没在水中的体积变小(假设此过程中溶液的体积变 化忽略不计),加入的固体物质可能是( )
一只盛有稀硫酸的烧杯中,漂浮着一块木块(如图),往烧杯加入适量某种固体物质后,木块浸没在水中的体积变小(假设此过程中溶液的体积变 化忽略不计),加入的固体物质可能是( )| A. | Ba(OH)2 | B. | Cu | C. | Fe | D. | BaCl2 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| OH- | NO3- | Cl- | SO42- | |
| H+ | - | 溶、挥 | 溶、挥 | 溶 |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 溶 | 溶 | 溶 | 微 |
| Ba2+ | 溶 | 溶 | 溶 | 不 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 一氧化碳与血红蛋白的结合能力比氧气强 | |
| B. | 室内着火如果打开门窗火反而烧得更旺 | |
| C. | 可以用燃着的火柴检查煤气管道是否漏气 | |
| D. | 篝火晚会时通常把木柴架空一些才能燃烧更旺 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com