
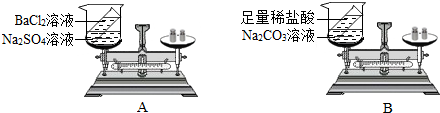
分析 ①书写化学方程式时要注意反应物和生成物的化学式,并且不要忘记配平和生成物状态符号.
②在表达质量守恒定律时,一定不要漏掉反应物或生成物的质量,特别是气体物质,容易忽略.
③从原子的角度解释质量守恒定律,主要是原子的种类,数目,质量都不改变角度分析.
④选择另外两种药品验证质量守恒定律时,除了两种物质要反应外,最好不生成气体物质.
解答 解:①书写化学方程式为:BaCl2+Na2S04=BaS04↓+2NaCl,Na2C03+2HCl=2NaCl+H20+C02↑;
②小刚的结论是正确的,因为在质量守恒定律中,反应物的总质量等于生成物的总质量,小莉的实验中反应后生成的气体逸散到空气中去了,可将反应物放在密闭容器中进行实验.
③从原子的角度解释质量守恒定律,是因为反应前后原子的种类,数目,质量都不改变.
④选择药品验证质量守恒定律时,两种物质要能反应,最好不生成气体物质,故可以选NaCl、AgNO3.
答案:①BaCl2+Na2S04=BaS04↓+2NaCl; Na2C03+2HCl=2NaCl+H20+C02↑;
③小刚;小莉的实验漏掉生成物的气体的质量,将反应物放在密闭容器中进行.
④在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变
⑤NaCl、AgNO3
点评 在验证质量守恒定律时,很容易忽略气体的质量,不管是反应物还是生成物中气体的质量,有气体参加或生成的实验必须在密闭容器中进行,这点一定要注意到.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用点燃的方法除去二氧化碳中混有的少量的一氧化碳 | |
| B. | 用带火星的木条鉴别氧气和空气 | |
| C. | 用碘水或碘酒检验火腿肠中是否含有淀粉 | |
| D. | 配制10%氯化钠溶液的一般步骤是:计算、称量、溶解 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 比较项目 | 实验操作 | 实验现象 | 得出结论 |
| 二氧化碳的含量 | 将澄清石灰水分别滴入盛有凌晨的空气和日照后的空气的集气瓶中 | 凌晨的空气变浑浊,日照后的空气中现象不明显 | 凌晨的空气中二氧化碳的含量比日照后的空气中更 高 |
| 氧气的含量 | 将燃着的木条分别伸入盛有凌晨的空气和日照后的空气你的集气瓶中 | 凌晨的空气中的木条很快熄灭,日照后的空气中的木条能燃烧一会再熄灭 | 凌晨的空气中氧气的含量比日照后的空气中更低 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com