
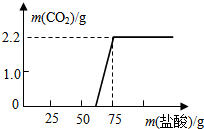
 某实验小组的同学对实验室久置的烧碱样品进行分析其变质程度,他们先称取13.3克的烧碱样品,配成溶液,然后向溶液中逐滴加入一定质量分数的稀盐酸,实验测得加入稀盐酸的质量与产生气体的质量关系如图所示:
某实验小组的同学对实验室久置的烧碱样品进行分析其变质程度,他们先称取13.3克的烧碱样品,配成溶液,然后向溶液中逐滴加入一定质量分数的稀盐酸,实验测得加入稀盐酸的质量与产生气体的质量关系如图所示:| 106 |
| 44 |
| X |
| 2.2克 |
| 73 |
| 44 |
| Y |
| 2.2克 |
| 5.3克 |
| 13.3克 |
| 40 |
| 36.5 |
| 8克 |
| Z |
| 10.95克 |
| 75克 |


科目:初中化学 来源: 题型:阅读理解

| 实 验 操 作 | 预期实验现象 | 结 论 |
| 固体产物是Na2CO3,而不是NaOH. | ||
| 固体产物是NaOH,而不是Na2CO3. |
查看答案和解析>>
科目:初中化学 来源: 题型:
 26、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
26、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.| 实 验 操 作 | 预期实验现象 | 结 论 |
| 固体产物是Na2CO3,而不是NaOH. | ||
| 固体产物是NaOH, 而不是Na2CO3. |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?临沂模拟)碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
(2012?临沂模拟)碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.| 实 验 操 作 | 预期实验现象 | 结 论 |
| 取少量固体产物,向其中加入 稀盐酸或稀硫酸 稀盐酸或稀硫酸 . |
有气泡产生 | 固体产物是Na2CO3,而不是NaOH. |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
 碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行了如下探究.
碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行了如下探究.| 实 验 操 作 | 实验现象 | 结 论 |
| 固体产物是Na2CO3,而不是NaOH. |
查看答案和解析>>
科目:初中化学 来源: 题型:
碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业。某化学兴趣小组的同学对碳酸氢钠的性质进行探究。
实验一:探究碳酸氢钠溶液的酸碱性
用pH试纸测得碳酸氢钠溶液的pH为10,由此可知碳酸氢钠溶液呈 性。
实验二:探究碳酸氢钠的热稳定性
[查阅资料]碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质。
 [进行实验]为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如右图所示。
[进行实验]为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如右图所示。
(1)加热一段时间后,观察到烧杯内壁有 。
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,
振荡,观察到石灰水变浑浊。写出该反应的化学方程式
。
(3)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3。
①他们猜想的依据是 。
②请设计实验检验反应后的固体产物是NaOH还是Na2CO3,并填入下表(只要求填写其中一行。若两行都写,按第一行计分):
| 实 验 操 作 | 预期实验现象 | 结 论 |
| 固体产物是Na2CO3,而不是NaOH。 | ||
| 固体产物是NaOH, 而不是Na2CO3。 |
[拓展应用]碳酸氢钠、碳酸钙、氢氧化镁等常用于制作抗酸药,用来治疗胃酸过多。但对于患有胃溃疡(胃黏膜溃烂)的病人在胃酸过多时,却不宜服用碳酸氢钠、碳酸钙等碳酸盐,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com