
���� ��1�����ݻ��ǿ�Ľ������ѻ�����Ľ�����������Һ���û������������������û���ͭ�������û���þ����ַ�Ӧ����ˣ����˳��Ĺ����еμ�ϡ���ᣬ��
��2������CuSO4���û�����Cu��FeSO4��Һ��MgSO4����Ӧ�����з�����ȷ����Һ���ʡ������ı仯��
��3����H2SO4��CuSO4�Ļ����Һ�м���m�˹��������ۣ��������������ᡢ����ͭ������Ӧ���ù���������Ϊm�ˣ�˵���˲μӷ�Ӧ���������ɵ�ͭ��������ȣ�������������ͭ��Ӧ�Ļ�ѧ����ʽ����ͭ�����������������ͭ��Ӧ������������������������ᷴӦ�������������������������ᷴӦ�ķ���ʽ��������������������������ȣ�
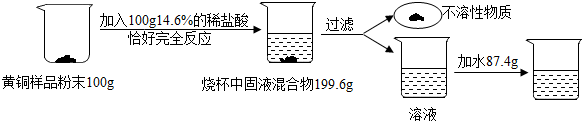
��� �⣺�����Һ�е�CuSO4���������û���Ӧ���õ�Cu��������ϡ���ᷴӦ����������������������Ϊ��һ�����������ۡ������Է�Ӧ����ҺM��һ�����е���������������������N��һ�����еĽ�����ͭ������MgSO4����Fe������Ӧ��������Һ�л�����MgSO4���ʣ�
��1��д������ϡH2SO4��Ӧ�Ļ�ѧ����ʽΪFe+H2SO4=FeSO4+H2����
��2����ҺM��һ�����е�������MgSO4��FeSO4������N��һ�����еĽ�����Cu��
��3���������ɵ�ͭ������Ϊ6.4g���������֪����μӷ�Ӧ����������Ϊ6.4g��
��������ͭ��Ӧ����������Ϊx������CuSO4������Ϊy��
Fe+CuSO4�TFeSO4+Cu
56 160 64
x y 6.4g
��$\frac{56}{x}=\frac{160}{y}=\frac{64}{6.4g}$����ã�x=5.6g��y=16g��
��ô�����ᷴӦ����������Ϊ��6.4g-5.6g=0.8g��
������Һ������H2SO4������Ϊz��
Fe+H2SO4�TFeSO4+H2��
56 98
0.8g z
��$\frac{56}{0.8g}=\frac{98}{z}$����ã�z=1.4g��
�����Һ������H2SO4��CuSO4��������Ϊ��1.4g��16g�T7��80
�ʴ�Ϊ��
��1��Fe+H2SO4=FeSO4+H2������2��MgSO4��FeSO4��Cu����3��7��80
���� �����ǶԽ������˳��Ŀ��飬����Ĺؼ������ս������˳��������壬���ݻ�ѧ����ʽ�Ľ�Ϊ���ӵļ��㣬�漰�Ļ�ѧ����ʽ����������������������ȷд����������ѧ����ʽ��Ȼ���������������������������⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
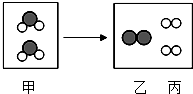 ��ͼ��ij��ѧ��Ӧ����ʾ��ͼ�������롰�𡱴�����ͬ��Ԫ�ص�ԭ�ӣ��������й�˵������ȷ���ǣ�������
��ͼ��ij��ѧ��Ӧ����ʾ��ͼ�������롰�𡱴�����ͬ��Ԫ�ص�ԭ�ӣ��������й�˵������ȷ���ǣ�������| A�� | ���е�һ������������ԭ�ӹ��� | |
| B�� | �÷�Ӧ��������ʾ���ˮ����ʾ��ͼ | |
| C�� | �÷�Ӧǰ��ԭ�ӵ��������Ŀ���� | |
| D�� | �÷�Ӧ����ѭ�����غ㶨�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ��̽����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ��̽����

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com