


 ×100%.
×100%.

科目:初中化学 来源: 题型:
 (1)KNO3、NaNO2、NaCl三种物质的溶解度受温度的影响最大的是
(1)KNO3、NaNO2、NaCl三种物质的溶解度受温度的影响最大的是 转化的是(A从溶液中析出时不带结晶水) (
转化的是(A从溶液中析出时不带结晶水) (查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (2009?连云港) NaNO2(亚硝酸钠)、NaCl和物质M (不含结晶水)的溶解度曲线如图所示,请根据图象和有关信息回答下列问题:
(2009?连云港) NaNO2(亚硝酸钠)、NaCl和物质M (不含结晶水)的溶解度曲线如图所示,请根据图象和有关信息回答下列问题: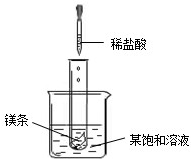
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
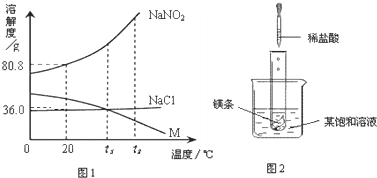
查看答案和解析>>
科目:初中化学 来源: 题型:
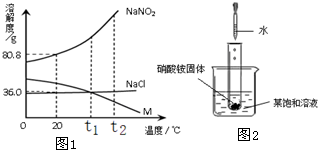
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com