
将氧化铜和铜的混合物2g加热,通入氢气使其质量不再减少为止,冷却称得剩余固体的质量1.68g,求原混合物中![]() 的质量分数。
的质量分数。
|
方法一:元素守恒法。在 2g-1.68g=0.32g,在 设
64+16 16 0.32g 方法二:差量法。
80 64 80-64=16
解得: 方法三:
80 64
解得: 方法四: 80 64
解得: 小结:一道题可以有不同的解题方法,但一定要有理论依据:质量守恒定律。可以依据化学方程式来做,也可以依据元素守恒来做。方法很多,不要限制在一种方法,要广开思路,培养创新精神。 |
|
读题可知: |


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:初中化学 来源:2012届度云南省初三综合复习化学试卷(解析版) 题型:探究题
氢氧化铜固体受热分解能得到两种氧化物,一种为固体,另一种是无色液体。某化学活动小组为确定这种固体产物是什么,进行了如下探究活动。
《假设》:生成的固体产物 ①可能是氧化亚铜(Cu2O)(红色) ;
②可能是 。
《设计实验》:小明用氢氧化钠溶液与硫酸铜溶液
反应制得氢氧化铜,放入试管中,使其在加热条件下分解(如下图),观察到蓝色粉末逐渐变成黑色。

请指出仪器名称:a ,b 。
《推测结论》:猜想______成立。
《形成结论》:写出氢氧化铜受热分解的化学方程式:_______________________________。
《查阅资料》知:(1)此黑色固体可用氢气还原,则小明选择下列________装置进行实验;
(2)已知Cu2O有如下性质:Cu2O+H2SO4==Cu+CuSO4+H2O ,在用氢气还原黑色固体后得到的铜中常混有少量Cu2O,取此Cu和Cu2O的
混合物共10g放入足量的稀硫酸中充分反应, 过滤得9.5g固体,则此混合物中Cu2O的质量分数为________。
《拓展与思考》:小华也用氢氧化钠溶液与硫酸铜溶液反应,但得到的沉淀不呈蓝色,而是浅绿色的;他又将此浊液加热直至沸腾,观察不到有分解变黑的迹象。为什么?小华查找资料得知,该浅绿色沉淀物是溶解度极小的碱式硫酸铜,其化学式为Cu4(OH)6SO4,同时还生成硫酸钠;此浅绿色沉淀能与酸反应,形成蓝色溶液。则碱式硫酸铜中铜元素的化合
价为______,请帮小华写出生成浅绿色沉淀的有关反应的化学方程式:_________________。
小华想设计一个实验,证明该浅绿色沉淀中含有硫酸根, 于是将沉淀过滤、洗涤,把沉淀再溶解在足量的无色溶液A中,取所得溶液滴加无色溶液B,若有大量白色沉淀生成,则表示原浅绿色沉淀中有SO42-,试推测:(1)无色溶液A的化学式是 ,无色溶液B的化学式是 ;
(2)写出产生白色溶液的化学方程式 。
查看答案和解析>>
科目:初中化学 来源:2011-2012学年云南省蒙自市博通总校初三化学综合复习化学试卷 题型:探究题
氢氧化铜固体受热分解能得到两种氧化物,一种为固体,另一种是无色液体。某化学活动小组为确定这种固体产物是什么,进行了如下探究活动。
《假设》:生成的固体产物 ①可能是氧化亚铜(Cu2O)(红色) ;
②可能是 。
《设计实验》:小明用氢氧化钠溶液与硫酸铜溶液
反应制得氢氧化铜,放入试管中,使其在加热条件下分解(如下图),观察到蓝色粉末逐渐变成黑色。

请指出仪器名称:a ,b 。
《推测结论》:猜想______成立。
《形成结论》:写出氢氧化铜受热分解的化学方程式:_______________________________。
《查阅资料》知:(1)此黑色固体可用氢气还原,则小明选择下列________装置进行实验;
(2)已知Cu2O有如下性质:Cu2O+H2SO4==Cu+CuSO4+H2O ,在用氢气还原黑色固体后得到的铜中常混有少量Cu2O,取此Cu和Cu2O的
混合物共10g放入足量的稀硫酸中充分反应, 过滤得9.5g固体,则此混合物中Cu2O的质量分数为________。
《拓展与思考》:小华也用氢氧化钠溶液与硫酸铜溶液反应,但得到的沉淀不呈蓝色,而是浅绿色的;他又将此浊液加热直至沸腾,观察不到有分解变黑的迹象。为什么?小华查找资料得知,该浅绿色沉淀物是溶解度极小的碱式硫酸铜,其化学式为Cu4(OH)6SO4,同时还生成硫酸钠;此浅绿色沉淀能与酸反应,形成蓝色溶液。则碱式硫酸铜中铜元素的化合
价为______,请帮小华写出生成浅绿色沉淀的有关反应的化学方程式:_________________。
小华想设计一个实验,证明该浅绿色沉淀中含有硫酸根, 于是将沉淀过滤、洗涤,把沉淀再溶解在足量的无色溶液A中,取所得溶液滴加无色溶液B,若有大量白色沉淀生成,则表示原浅绿色沉淀中有SO42-,试推测:(1)无色溶液A的化学式是 ,无色溶液B的化学式是 ;
(2)写出产生白色溶液的化学方程式 。
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O N2+3Cu+3H2O
N2+3Cu+3H2O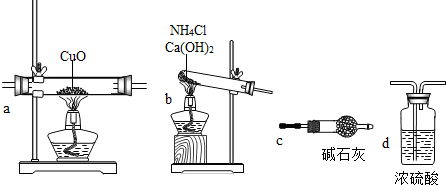
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.用过滤的方法分离氯化钠和硝酸钠 |
| B.向某无色未知溶液中加入氯化钡,证明存在硫酸根离子 |
| C.用稀盐酸除去混在铜粉里的少量镁粉和铝粉 |
| D.将氢气和氧气的混合气体通过灼热的氧化铜试管,以除去氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com