
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:初中化学 来源: 题型:
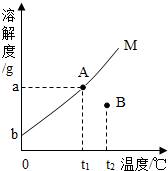 根据固体物质M在水中的溶解度曲线图,回答下列问题:
根据固体物质M在水中的溶解度曲线图,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
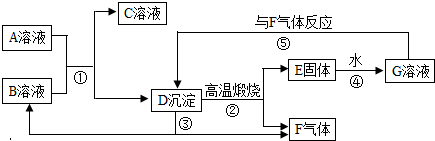
查看答案和解析>>
科目:初中化学 来源: 题型:
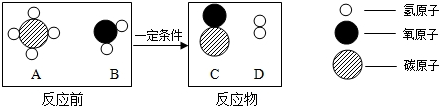
 ”表示氧原子,“
”表示氧原子,“ ”表示氢原子)
”表示氢原子)
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验步骤 | 实验现象 | 结论 |
| 1.取少许该溶液于试管中,滴 入适量的 | 猜想二正确 | |
| 2.静置上述溶液,取上层清液少许于另一支试管中,滴入几滴 | 猜想二正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:
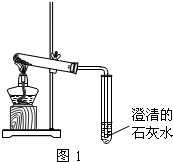 某学习小组的同学在学习了Na2CO3、NaHCO3的性质后,了解到它们都能与盐酸反应产生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究:
某学习小组的同学在学习了Na2CO3、NaHCO3的性质后,了解到它们都能与盐酸反应产生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究: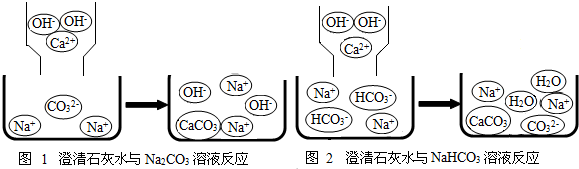
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com