
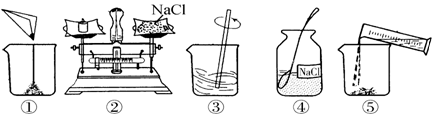
分析 (1)根据实验操作示意图中所涉及的玻璃仪器进行分析解答.
(2)根据托盘天平的使用要遵循“左物右码”的原则,进行分析解答.
(3)利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量;再根据溶剂质量=溶液质量-溶质质量即可求得水的质量,进而确定量筒的量程.
(4)根据配制溶质质量分数一定的溶液的基本步骤进行分析解答.
解答 解:(1)图中的玻璃仪器分别是广口瓶、量筒、烧杯和玻璃棒.
(2)托盘天平的使用要遵循“左物右码”的原则,图中称量时药品与砝码的位置放反了.
(3)溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为12%的NaCl溶液,需氯化钠的质量=100g×12%=12g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-12g=88g(合88mL);选取量筒时,尽量选用能一次量取的最小规格的量筒.用量筒量取88mL水,应选择100mL的量筒.
(4)配制100g溶质质量分数为12%的NaCl溶液的步骤:计算、称量(量取)、溶解、装瓶贴签,用图示的序号表示为:④②①⑤③.
故答案为:(1)玻璃棒;(2)药品与砝码的位置放反了;(3)100;(4)④②①⑤③.
点评 本题难度不大,明确配制一定溶质质量分数的溶液实验步骤(计算、称量、溶解)、注意事项等是正确解答本题的关键.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:多选题
| A. | 压强减小,溶解在汽水中的二氧化碳外逸 | |
| B. | 压强增大,溶解在汽水中的二氧化碳外逸 | |
| C. | 温度升高,溶解在汽水中的二氧化碳外逸 | |
| D. | 温度降低,溶解在汽水中的二氧化碳外逸 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 将大小相同并打磨光亮的铬片、铝片、铜片分别放入盛有体积相同、质量分数相同的稀硫酸的试管中. | 铬片表面产生气泡较慢, 铝片表面产生气泡较快,铜片表面无明显现象 | 猜想三成立,铬与稀硫酸反应的化学方程式为Cr+H2SO4═CrSO4+H2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
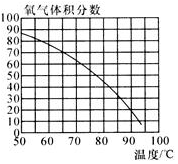 小亮发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃.那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小亮对此展开探究:
小亮发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃.那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小亮对此展开探究:| 第一组 | 第二组 | 第第三组 | |||||||||
| 集气瓶编号 | ① | ② | ③ | ④ | ⑤ | ① | ② | ③ | ④ | ⑤ | ① |
| 收集的O2占容积的体积分数(%) | l0 | 20 | 30 | 40 | 50 | 3l | 33 | 35 | 37 | 39 | 34 |
| 带火星木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 | 很亮 | 很亮 | 复燃 | 复燃 | 复燃 | 很亮 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
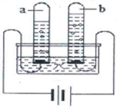 由于水的导电性很弱,为了增强水的导电性,做电解水实验时常在水中加入少量氯化钠固体(在水电解过程中,氢氧化钠质量和性质都不发生变化).把180克氢氧化钠的质量分数为1%的溶液进行电解,电解结束后氢氧化钠的质量分数为1.2%.
由于水的导电性很弱,为了增强水的导电性,做电解水实验时常在水中加入少量氯化钠固体(在水电解过程中,氢氧化钠质量和性质都不发生变化).把180克氢氧化钠的质量分数为1%的溶液进行电解,电解结束后氢氧化钠的质量分数为1.2%.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质 | 质量(克) |
| 坩埚+硫酸铜晶体 | 45.5 |
| 坩埚+无水硫酸铜 | 36.5 |
| 坩埚 | 20.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com