
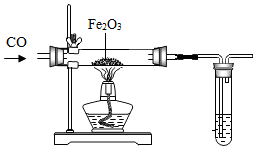
 冶炼金属通常是指从矿石中提取金属单质的过程,除“沙土淘金”等物理方法外,金属冶炼大都是使金属从其化合态(化合物)转化为游离态(单质)的化学过程.根据金属的化学性质不同,工业上冶炼金属一般有以下几种方法.
冶炼金属通常是指从矿石中提取金属单质的过程,除“沙土淘金”等物理方法外,金属冶炼大都是使金属从其化合态(化合物)转化为游离态(单质)的化学过程.根据金属的化学性质不同,工业上冶炼金属一般有以下几种方法.分析 1、根据反应原理以及化学方程式的写法来分析;
(1)根据基本反应类型的判断方法来分析;
(2)氢气具有还原性,可以将金属氧化物还原为金属单质;
(3)根据生成物均为固体来分析;
(4)①根据题干信息来分析;
②根据二氧化碳的化学性质来分析;
③尾气中含有一氧化碳;
④根据化学方程式进行计算,根据生铁中的含碳量来分析;
⑤根据实验中的注意事项来分析;
【查阅资料】根据质量守恒定律来分析解答;
【合理猜想】根据题干信息以及物质的性质来分析.
解答 解:1、氯化镁在通电的条件下分解为镁和氯气;故填:MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
(1)这两个化学反应都是由一种单质与一种化合物反应生成另一种单质与另一种化合物,属于置换反应;故填:置换反应;
(2)氢气具有还原性,如在加热的条件下,氢气将氧化铜还原为金属铜,同时生成水;故填:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
(3)反应后得到的是氧化铝与铬的混合物,得到的金属单质中混有其他物质;故填:得到的产品不纯净;
(4)①金属跟氧结合成金属氧化物的过程称为金属的氧化,金属氧化物失去氧转化为金属的过程,称为金属氧化物的还原.则Fe2O3→Fe是由金属氧化物失去氧转化为金属的过程,称为金属氧化物的还原;故填:金属氧化物的还原;
②大试管中的澄清石灰水吸收二氧化碳后会生成白色的碳酸钙沉淀,所以石灰水的作用是检验一氧化碳炼铁后有二氧化碳生成;故填:检验一氧化碳炼铁后有二氧化碳生成;
③尾气中含有一氧化碳,是一种有毒气体,直接排放到空气中造成了污染,故填:需要添加尾气处理装置;
④设生成铁的质量为x,则
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 112
8g x
$\frac{160}{112}=\frac{8g}{x}$
x=5.6g
假设其中只含有碳元素一种杂质为2.8%,则可能生铁的质量为5.6g÷(1-2.8%)=5.76g;故填:5.6g;5.76g;
⑤待反应完成之后,立即停止一氧化碳气体的通入,造成玻璃管内的压强减小,在外界大气压的作用下,大试管中的石灰水进入玻璃管造成玻璃管炸裂;故填:玻璃管炸裂;玻璃管内的压强减小,在外界大气压的作用下,大试管中的石灰水进入玻璃管;
【查阅资料】由质量守恒定律可知,化学反应前后原子的种类与数目不变,反应前:3个铁原子、4个氧原子、8个氢原子和8个氯原子;反应后:2个铁原子、4个氧原子、8个氢原子和6个氯原子,所以空格处的化学式为FeCl2;故填:FeCl2;
【合理猜想】铁能被磁铁吸引,与稀盐酸反应生成氯化亚铁和氢气;四氧化三铁能被磁铁吸引,且与稀盐酸反应生成的氯化铁溶液为黄色;氧化亚铁不能被磁铁吸引,
由题干信息“把得到的黑色固体倒在一张白纸上,用磁铁吸引.发现粉末没有全部被吸引;将足量稀盐酸加入装有少量该黑色粉末的试管中,振荡,观察到粉末完全溶解且有气泡产生,溶液由无色变为棕黄色”可知,此黑色粉末中含有Fe、Fe3O4、FeO;故填:Fe、Fe3O4、FeO.
点评 本题难度不是很大,掌握一氧化碳与氧化铁的实验原理、注意事项、实验现象等是正确解答本题的关键.


科目:初中化学 来源: 题型:选择题
| A. | 氢氧化钾溶液和稀硫酸混合 | B. | 氧化铝固体粉末加入稀盐酸中 | ||
| C. | 碳酸氢钠溶液和稀盐酸混合 | D. | 二氧化硫气体通入氢氧化钠溶液中 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 待鉴别的物质 | 鉴别方法 |
| A | 碳粉与氧化铜 | 滴加稀硫酸,观察现象 |
| B | 酒精与白醋 | 闻气味 |
| C | 碳酸钡与氯化钠固体 | 加足量的水,观察是否溶解 |
| D | 稀硫酸与硫酸钠溶液 | 滴加酚酞溶液,观察溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
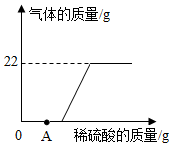 实验后的废液一般需回收处理,不能直接倒入排污管.小明实验后收集到含有碳酸钾和氧氧化钾的废水样品50g,他向废液中缓缓滴入溶质质量分数为10%的稀硫酸,生成二氧化碳质量与滴入稀硫酸质量的关系如图所示,当废液恰好处理完毕时,溶液总质量为194.8g,溶于水的气体忽略不计,则:
实验后的废液一般需回收处理,不能直接倒入排污管.小明实验后收集到含有碳酸钾和氧氧化钾的废水样品50g,他向废液中缓缓滴入溶质质量分数为10%的稀硫酸,生成二氧化碳质量与滴入稀硫酸质量的关系如图所示,当废液恰好处理完毕时,溶液总质量为194.8g,溶于水的气体忽略不计,则:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 三种物质CuSO4、Mg(NO3)2、CaO可以共存于同一溶液中 | |
| B. | 盐都是由金属阳离子和酸根阴离子构成 | |
| C. | 只用水就能区分CaCO3、NaOH、NaCl、NH4NO3四种白色固体 | |
| D. | 某可燃物燃烧后生成的产物中有CO2、CO和SO2,则该物质一定含有碳、硫、氧元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 事实 | 解释 | |
| A | 50mL水和50mL酒精混合后的体积小于100mL | 分子之间有间隔 |
| B | 金秋时节,丹桂飘香 | 分子是在不断地运动的 |
| C | 过氧化氢和水的化学性质不同 | 分子的构成不同 |
| D | 温度计中的水银(汞)热胀冷缩 | 原子本身的大小发生了改变 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com