
| 稀硫酸用量 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 | 第6份 |
| 剩余固体质量 | 2.4g | m | n | 0.6g | 0.6g | 0.6g |
分析 (1)根据表格中的数据,通过对比分析与每份稀硫酸恰好完全反应的镁的质量,进而可确定m的值;
(2)反应前后固体物质减少的质量为镁的质量,根据质量分数的计算公式可以求出镁铜合金中镁的质量分数;
(3)根据每10g稀硫酸只能消耗0.6g镁进行计算,算出硫酸质量,再根据质量分数的计算公式计算即可.
解答 解:(1)由表格数据,通过对比分析可知,每10g硫酸就消耗0.6g镁,因此m=2.4g-0.6g=1.8g,
(2)由表中的数据可以知道,第4、5、6次加入稀硫酸后金属的质量没有改变,所以可以判断铜的质量为0.6g,所以镁的质量分数为=$\frac{3.0g-0.6g}{3.0g}$×100%=80%.
(3)设10克稀硫酸中所含H2SO4的质量为x.
Mg+H2SO4=MgSO4+H2↑
24 98
0.6g x
$\frac{24}{0.6g}=\frac{98}{x}$
解得:x=2.45g
稀硫酸的溶质质量分数为:$\frac{2.45g}{10g}$×100%=24.5%.
故答案为:(1)2.5;(2)合金样品中镁的质量分数为80%;(3)所用稀硫酸中H2SO4的质量分数24.5%.
点评 本题属于表格数据题,解题的关键是能够通过表中的数据,分析出完全反应的量,同时由表中的数据分析出想要的数据才能进行解题.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 生活污水可以任意排放 | B. | 淡水是取之不尽、用之不竭的 | ||
| C. | 水是一种最常用的溶剂 | D. | 水分子由氢分子和氧原子构成 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 原子核是由质子和中子构成的,所以任何原子的原子核都含有质子和中子 | |
| B. | 酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱的反应 | |
| C. | 二氧化锰可以加快过氧化氢分解速率,所以二氧化锰可做任何反应的催化剂 | |
| D. | 溶液一定是均一稳定的,但均一稳定的物质不一定是溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 相同点 | |
| A | 金刚石与石墨 | 常温下化学性质不活泼 |
| B | 不锈钢和焊锡 | 都是合金 |
| C | 棉纤维和羊毛纤维 | 都属于天然纤维 |
| D | 纯碱和熟石灰 | 都是碱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
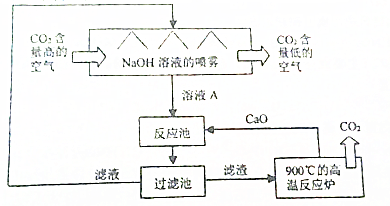
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
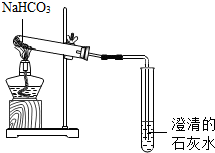 Na2CO3、NaHCO3是生活中常见的盐,某实验小组通过以下实验来研究者离子物质的性质(已知:Na2CO3、NaHCO3的水溶液呈碱性;NaHCO3受热易分解生成Na2CO3、H2O和CO2).
Na2CO3、NaHCO3是生活中常见的盐,某实验小组通过以下实验来研究者离子物质的性质(已知:Na2CO3、NaHCO3的水溶液呈碱性;NaHCO3受热易分解生成Na2CO3、H2O和CO2).查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com