
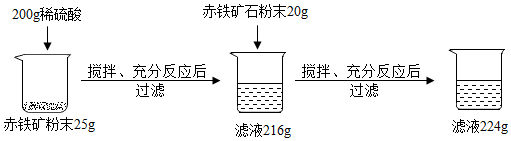
分析 氧化铁和稀硫酸反应生成硫酸铁和水,根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断.
解答 解:上述实验过程中,氧化铁和稀硫酸反应生成硫酸铁和水,发生反应的化学方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.根据化学方程式可知,溶液的质量增加量也就是参加反应的氧化铁的质量.
加入25g赤铁矿时,溶液质量增加了16g,而再加20g赤铁矿,按照前面的比例如果酸足量,则应该溶液增加12.8g而得到216g+12.8g=228.8g溶液,现在只得到224g,说明铁矿石没有完全反应,而硫酸完全反应了,此时反应的氧化铁的质量为224g-200g=24g.
应该以第一次加入赤铁矿时的数据计算样品中氧化铁的质量分数;
样品中Fe2O3的质量分数是:$\frac{216g-200g}{25g}$×100%=64%,
根据分析可知,200g硫酸与24g氧化铁恰好反应.
设200g硫酸中溶质的质量为x,生成的硫酸铁的质量为y
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
160 294 400
24g x y
$\frac{160}{24g}$=$\frac{294}{x}$=$\frac{400}{y}$
x=44.1g
y=60g
若向最终滤液中加入16g水,所得不饱和溶液中溶质的质量分数为$\frac{60g}{224g+16g}$×100%=25%;
该钢铁厂每天用上述赤铁矿石1900t来生产生铁,则理论上日产含杂质5%的生铁的质量为1900t×64%×$\frac{56×2}{56×2+16×3}$×100%÷(1-5%)=896t.
故填:
(1)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)64%;
(3)$\frac{160}{24g}$=$\frac{294}{x}$或者$\frac{160}{294}$=$\frac{24g}{x}$;
(4)25%;
(5)896t.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


科目:初中化学 来源: 题型:选择题
| A. | 肥皂水遇软水能够产生大量气泡,遇硬水产生泡沫较少并有浮渣产生 | |
| B. | 水由氢原子和氧原子构成 | |
| C. | 水分子保持水的化学性质 | |
| D. | 水的三态变化只是水分子之间的空隙发生变化,发生的是物理变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验装置 | 【实验1】制备气体 | 【实验2】测定空气中氧气含量 |
 | 左管中带孔的燃烧匙盛有足量锌粒,右管盛有稀硫酸 Ⅰ.打开K1和K2,使反应发生 Ⅱ.在K1的导管口处收集气体 Ⅲ.… | 左管中燃烧匙盛有足量白磷,右管盛有水 Ⅰ.光照引燃白磷 Ⅱ.待白磷熄灭,冷却,打开K2,至液面不再变化,右管中液体的高度为h1 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com