
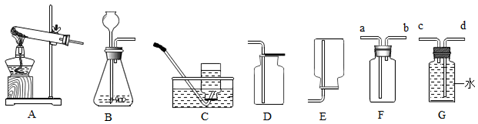
分析 根据已有的气体制取的知识进行分析解答,气体发生装置的选择与反应物的状态和反应条件有关,收集装置的选择与气体的密度和溶解性有关,据此解答.
解答 解:(1)加热KMnO4制取并收集较干燥的O2,是固体加热型反应,选择A装置制取,收集干燥的氧气使用向上排空气法收集,故填:AD;
(2)以B和F组合可制取气体,可以是过氧化氢在二氧化锰的催化作用下分解生成水和氧气,用G装置收集该气体,是排水法收集氧气,氧气应该从c端进入,故填:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑; c.
点评 本题考查的是常见的气体制取的知识,完成此题,可以依据已有的知识进行.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:初中化学 来源: 题型:解答题
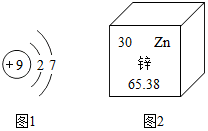 人体必需的微量元素有铁、氟、锌、硒、碘等.它们在人体内虽然含量少,但对健康至关重要.
人体必需的微量元素有铁、氟、锌、硒、碘等.它们在人体内虽然含量少,但对健康至关重要.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
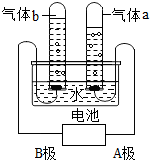 根据如图简易电解水的装置回答问题
根据如图简易电解水的装置回答问题查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 需要区分的物质 | 实验方法 |
| A | 涤纶线和羊毛线 | ①观察颜色②点燃观察 |
| B | 木炭粉和铁粉 | ①用磁铁吸引②加稀盐酸 |
| C | 稀硫酸和纯碱溶液 | ①闻气味 ②滴加无色酚酞溶液 |
| D | 硬水和软水 | ①加肥皂水②过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
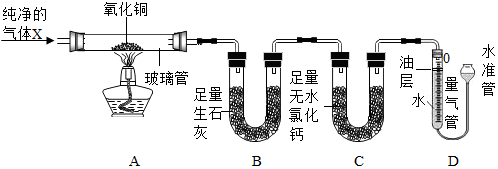
| 数据编号 测量项目 | Ⅰ | Ⅱ |
| 玻璃管(含药品)的质量/g | 54.40 | 53.92 |
| B装置(含药品)的质量/g | 104.00 | 104.54 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com