
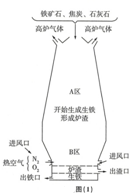
 钢铁工业是国家工业的基础.
钢铁工业是国家工业的基础.
| 物质 性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
分析 (1)高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳;
碳燃烧生成二氧化碳,二氧化碳在高温条件下和碳反应生成一氧化碳;
(2)为了防止发生爆炸,加热前应该先通入一会儿一氧化碳,反应结束后,应该继续通入一氧化碳直至玻璃管冷却至室温;
(3)氢氧化钠溶液能够吸收二氧化碳;
氧化铁中铁元素质量分数=$\frac{112}{160}$×100%=70%;
根据实验现象可以判断相关方面的问题;
铁和稀盐酸反应生成氯化亚铁和氢气.
解答 解:(1)A区中,氧化铁和一氧化碳反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
B区中,碳燃烧生成二氧化碳,二氧化碳和碳反应生成一氧化碳,反应的化学方程式分别为:C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO.
故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO.
(2)A.应该是玻璃管中的固体由红色逐渐变成黑色,该选项说法不正确;
B.取10g样品与足量CO充分反应后,测得剩余固体的质量为7.6g,说明氧化铁中氧元素质量为:10g-7.6g=2.4g,则氧化铁质量为:2.4g÷30%=8g,
设反应需要一氧化碳质量为x,生成二氧化碳质量为y,
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,
160 84 132
8g x y
$\frac{160}{8g}$=$\frac{84}{x}$=$\frac{132}{y}$,
x=4.1g,y=6.6g,
因为反应前后要通入一氧化碳,因此实验中通入CO的质量应该大于4.2g,该选项说法不正确;
C.生成CO2的质量是6.6g,该选项说法不正确;
D.铁矿石样品中Fe2O3的质量分数为:$\frac{8g}{10g}$×100%=80%,该选项说法正确.
故填:D.
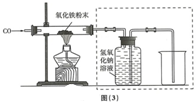
(3)【分析与讨论】
她质疑的理由是如果黑色固体全部是铁,则质量应该为:6.0g×70%=4.2g,不应该是5.8g.
故填:如果黑色固体全部是铁,则质量应该为:6.0g×70%=4.2g,不应该是5.8g.
【实验与猜想】
①该小组的同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和氧化亚铁.
故填:氧化亚铁.
②黑色固体粉末可能是四氧化三铁,或四氧化三铁和铁.
故填:四氧化三铁;四氧化三铁和铁.
【得出结论】
假设产物是四氧化三铁,生成四氧化三铁质量为z,
3Fe2O3+CO$\frac{\underline{\;高温\;}}{\;}$2Fe3O4+3CO2,
480 464
6.0g z
$\frac{480}{6.0g}$=$\frac{464}{z}$,
z=5.8g,
与假设符合,因此通过实验中获得的数据进行计算,得出黑色固体粉末为四氧化三铁.
故填:四氧化三铁.
【反思与评价】
②实验装置图(3)中采用虚线框内的装置,其作用有收集一氧化碳,吸收二氧化碳.
故填:AB.
③工业上炼出的生铁与实验还原出来的铁的区别是:工业上炼出的生铁中含有碳,而实验还原出来的铁中不含有碳;
将工业上炼出的生铁少量放于烧杯中,加入足量稀盐酸的现象是固体部分溶解,产生气泡,溶液变成浅绿色.
故填:工业上炼出的生铁中含有碳,而实验还原出来的铁中不含有碳;固体部分溶解,产生气泡,溶液变成浅绿色.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②④⑤⑥⑦⑧ | B. | ②④⑤⑥⑦⑧ | C. | ②⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 任取三种溶液于三支试管中,分别滴加第四种溶液 | ①一支试管中有气泡放出,其余两支试管中无明显变化 | ①第四种溶液为稀盐酸 |
| ②一支试管中有白色沉淀析出,其余两支试管中溶液无明显变化 | ③第四种为Na2CO3溶液 | |
| ④三支试管中溶液均无明显变化 | ②第四种为NaOH溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H2 | B. | CH4 | C. | He | D. | CO |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com