
| A. | 5.6克 | B. | 10克 | C. | 7.8克 | D. | 无法确定 |
分析 根据氧化钙和水会生成氢氧化钙,然后根据天平两端增加的质量需要相等时,才能平衡.
解答 解:氧化钙和水反应生成氢氧化钙,左盘烧杯内放入5.6克氧化钙,反应后左边增加2.2g,所以右边增加的质量需要是5.6g.
50克、溶质质量分数7.3%的稀盐酸所含HCl的质量为50g×7.3%=3.65g
设加入碳酸钙的质量是x,增加量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑ 增加质量
100 73 44 56
x 3.65g y
$\frac{100}{x}$=$\frac{73}{3.65g}$=$\frac{56}{y}$
x=5g
y=2.8.
所以为维持平衡需要继续加入5.6g-2.8g=2.8g的碳酸钙维持平衡(这2.8g碳酸钙不参加反应)
所以加入的碳酸钙的质量为5g+2.8g=7.8g
答案:C
点评 在解此类题时,首先根据题意分析两边增加的质量,然后再列出关系式进行解答.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
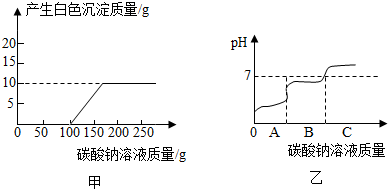
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe$\stackrel{点燃}{→}$Fe2O3$\stackrel{稀H_{2}SO_{4}}{→}$Fe2(SO4)3溶液 | |
| B. | C$\stackrel{点燃}{→}$CO$→_{△}^{CuO}$CO2$\stackrel{NaOH溶液}{→}$Na2CO3溶液 | |
| C. | Cu$\stackrel{稀H_{2}SO_{4}}{→}$CuSO4$\stackrel{Fe}{→}$Cu | |
| D. | CaO$\stackrel{H_{2}O}{→}$Ca(OH)2$\stackrel{Na_{2}CO_{3}溶液}{→}$NaOH溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
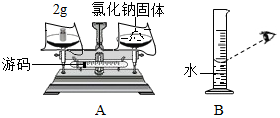 实验室欲配制50克溶质质量分数为5%的氯化钠溶液,试回答下列问题:
实验室欲配制50克溶质质量分数为5%的氯化钠溶液,试回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com