考点:氧气的制取装置,氧气的收集方法,制取氧气的操作步骤和注意点,有关元素化合价的计算,书写化学方程式、文字表达式、电离方程式
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)根据实验室常用仪器解答;
(2)根据在化合物中正负化合价代数和为零,进行解答.根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
根据化合物中元素的质量分数=
×100%,计算即可;
(3)根据氯酸钾受热时能够分解生成氯化钾和氧气;利用加热的方法制取气体,并且利用排水法收集气体时,要按照一定的步骤进行,特别是要注意集满气体后的操作顺序,以防发生安全事故;
(4)通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;若要收集较纯净的氧气选:排水法;
解答:解:
(1)根据实验室常用仪器可知:a酒精灯;b试管;c铁架台;d集气瓶;
(2)根据在化合物中正负化合价代数和为零,钾元素化合价为+1价,氧元素的化合价为-2价,设KMnO
4中锰元素的化合价为x,则:(+1)+x+(-2)×4=0,解答 x=+7.高锰酸钾中钾、锰、氧三种元素的质量比39:55:(16×4)=39:55:64.
高锰酸钾中氧元素的质量分数为:
100%≈40.5%;高锰酸钾受热时能够分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式为:2KMnO
4 K
2MnO
4+MnO
2+O
2↑;
(3)实验室用氯酸钾制取氧气需要加热,属于固固加热型,制取装置为A,反应的化学方程式为:2KClO
32KCl+3O
2↑.此时试管口应略向下倾斜,是为了防止水蒸气冷凝、回流炸裂试管;
(4)实验室若用过氧化氢和二氧化锰制取氧气时,属于固液常温型,应选用制取装置B;该反应的化学方式为:2H
2O
22H
2O+O
2↑,若要收集较纯净的氧气选用收集装置,为排水法,故选E.
答案:
(1)a酒精灯;b试管;c铁架台;d集气瓶;
(2)+7; 39:55:64; 40.5%;2KMnO
4 K
2MnO
4+MnO
2+O
2↑;
(3)A 2KClO
32KCl+3O
2↑ 防止水蒸气冷凝、回流炸裂试管
(4)B 2H
2O
22H
2O+O
2↑ E
点评:本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.

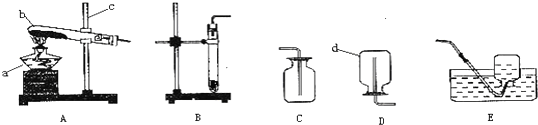


 如图是加热高锰酸钾制氧气的装置,回答问题:
如图是加热高锰酸钾制氧气的装置,回答问题:
