
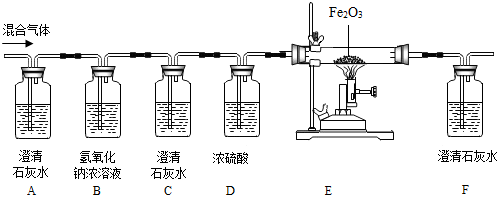
分析 根据金属活动性顺序表的应用分析.在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.
解答 解:(1)将铜丝和铁丝分别放入相同浓度的稀H2SO4中,铁能与稀硫酸反应生成氢气,铜不能与稀硫酸反应,所以,依据铁丝的表面有气泡生成而铜的表面没有的现象,证明Fe的活动性比Cu强;
(2)由于铜的活动性比银强,将铜丝放入AgNO3溶液中,铜能将银置换出来,生成了银和硝酸铜,反应的方程式是:Cu+2AgNO3═2Ag+Cu(NO3)2;
(3)A.Fe能与CuSO4溶液反应,Ag不能与CuSO4溶液反应,说明了金属的活动性顺序是铁>铜>银,故A正确;
B.Cu、Ag都不与FeSO4溶液反应,说明了金属的活动性是铁大于铜、银,但不能比较铜、银的活动性;故B错误;
C.Fe、Cu都能与AgNO3溶液反应,说明了铁、铜的活动性大于银,但不能比较铁、铜的活动性,故C错误.
故答为:(1)铁丝的表面有气泡生成而铜的表面没有; (2)Cu+2AgNO3═2Ag+Cu(NO3)2;(3)A.
点评 要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
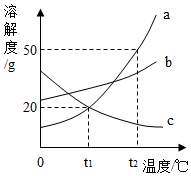 如图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )
如图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )| A. | 随温度升高,a、b、c三种物质的溶解度均增大 | |
| B. | t2℃时,三种物质的溶解度大小关系:a>b>c | |
| C. | t2℃时,把50ga放入50g水中,可得到100ga的饱和溶液 | |
| D. | 将t2℃时,a、b、c的饱和溶液降温到t1℃,均有晶体析出 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧化物就是含氧元素的化合物 | |
| B. | 均一、稳定的液体一定是溶液 | |
| C. | 硝酸钾在20℃时的溶解度是31.6g,则该温度下100g的硝酸钾饱和溶液中含有硝酸钾31.6g | |
| D. | 单质是由同种元素组成的纯净物 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
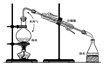 蒸馏装置中冷水进入的方向是从冷凝管的下方进入
蒸馏装置中冷水进入的方向是从冷凝管的下方进入 稀有气体可制霓虹灯的原因稀有气体通电时可发出不同颜色的光.
稀有气体可制霓虹灯的原因稀有气体通电时可发出不同颜色的光.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com