
【题目】实验小组同学做了如下实验:

(1)仪器①的名称是 _____________。某同学用A装置制氧气,其他同学认为该装置有个缺陷,改进方法是 ______________________________,将带火星的木条置于a处,若观察到_______________________________,说明已有氧气产生。
(2)B中现象是量筒内涌出柱状的泡沫,可形象地称为“大象牙膏”,其原理主要是H2O2在碘化钾(KI)催化作用下迅速分解,该反应的化学方程式为_____________。
该实验中的发泡剂是洗洁精,洗洁精能除去油污是因为洗洁精具有______作用。
【答案】 铁架台 在试管口塞一团棉花 带火星木条复燃 ![]() 乳化
乳化
【解析】(1)根据高锰酸钾制取氧气的实验装置及氧气的检验分析解答;
(2)通常情况下,过氧化氢在某些催化剂的作用下,分解生成水和氧气,根据反应原理书写化学方程式;依据洗洁精的去污原理分析。
解:(1)仪器①的名称是铁架台。实验室用高锰酸钾制取氧气时为防止高锰酸钾粉末进入导管,需在试管口放一团棉花。故改进方法是在试管口塞一团棉花。将带火星的木条置于a处,是在检验是否有氧气生成。检验是否有氧气生成的方法是看带火星的木条是否复燃。故若观察到带火星木条复燃,说明已有氧气产生;
(2)过氧化氢在某些催化剂的作用下分解的化学方程式为2H2O2 ![]() 2H2O+O2↑。洗洁精能除去油污是因为洗洁精具有乳化作用。
2H2O+O2↑。洗洁精能除去油污是因为洗洁精具有乳化作用。


 学习实践园地系列答案
学习实践园地系列答案科目:初中化学 来源: 题型:
【题目】黄铁矿(主要成分为FeS2,杂质不含硫元素)是我国大多数硫酸厂制取硫酸的主要原料。化学课外活动小组为测定某黄铁矿中FeS2含量进行了如下的实验探究(假设每步反应均完全)。
【查阅资料】 ①4FeS2+11O2 ![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
②Na2SO3+H2O2=Na2SO4+H2O
【实验探究】
Ⅰ. 称取2.40 g黄铁矿样品放入下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
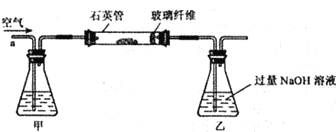
Ⅱ. 反应结束后,将乙瓶中的溶液进行如下处理:
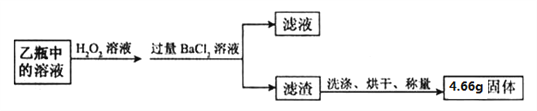
【问题讨论】
(1)Ⅰ装置中甲瓶内盛放的试剂是氢氧化钠溶液,其作用是______________。
(2)Ⅰ装置中乙瓶内发生反应的化学反应方程式是____________________。
【含量测定】
(3)计算该黄铁矿中FeS2的质量分数__________________。(请写出计算过程)
【交流反思】
(4)如果缺少甲装置,则最终测得FeS2的质量分数将会________________(填“偏大”“偏小”或“不变”)。
(5)Ⅱ中检验滤渣是否洗涤干净的方法是,取最后一次洗涤液,加入_____________,说明已洗涤干净。
【拓展应用】
工业上以黄铁矿为原料生产硫酸的工艺流程图如下所示:
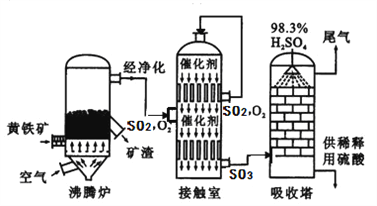
(6)接触室中发生反应的化学方程式为________________________。化学实验室常需要用到较稀的硫酸,把浓硫酸稀释的操作是_______________________________________,硫酸是一种重要的化工产品,用途十分广泛,请写出稀硫酸的一种用途______________________。
(7)依据生产硫酸的工艺流程图,下列说法正确的是_______________(填字母)。
A.为使黄铁矿充分燃烧,需将其粉碎 B.催化剂能够提高SO2的反应速率和产量
C.沸腾炉排出的矿渣可供炼铁 D.吸收塔中为了提高吸收效率,采用喷淋的方式
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】漂白粉的主要成分为次氯酸钙 [Ca(ClO)2] 和氯化钙,即可用作漂白剂,又可用作消毒剂。漂白粉中有效成分是 [Ca(ClO)2] ,漂白的原理是:Ca(ClO)2在空气中发生反应。Ca(ClO)2+ CO2+ H2O=CaCO3↓+ 2HClO;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色。
(1)HClO在常温下分解,反应为2HClO=2HCl+ O2↑。某瓶HClO溶液放置一段时间后,溶液的pH________ (填“增大”或“减小”或“不变”)。
(2)在漂白粉中滴加盐酸,能加快漂白的速率。写出漂白粉中加入盐酸反应的化学方程式______________。
(3)有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列探究实验。
【提出问题】长时间放置的漂白粉是否变质?
【猜 想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为_______________________;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3。
【实验探究】限选试剂及仪器,盐酸、石灰水、品红溶液、试管、带导管的单孔塞。
实验操作 | 实验现象 | 实验结论 |
①取少量样品于试管中, ____________________________。 | 有气体产生,气体使石灰水变浑浊。 | 猜想2成立 |
②在上述反应后试管中加少量 _____________。 | _________________________。 |
(4)现有实验后的HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如下实验方案:

【实验数据】上述实验中100g混合溶液与mg溶质的质量分数为10.6%的Na2CO3溶液恰好完全反应后,共记录了两组实验数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g.
根据实验设计及有关数据进行分析与计算:
(1)m=______.
(2)上述实验中100g混合溶液与mg溶质的质量分数为10.6%的Na2CO3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为多少?.(不考虑过滤中的损失,计算结果保留到小数点后一位.)__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与稀硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】①可能与稀硫酸的溶质质量分数有关;②可能与锌的形状有关。
【设计并实验】兴趣小组用100mL不同质量分数的稀硫酸和5g不同形状的锌进行如下实验(时间为3分钟)。

(1)锌与硫酸反应的化学方程式为_______________________________。
(2)如图所示装置收集并测量氢气的体积,则正确的链接顺序是:
氢气→______________________(填导管口序号)。
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是______。
【得出结论】依据上表得出的结论是____________________________________。
【反思评价】
(4)下表是兴趣小组第①组实验根据前6分钟记录详细数据(每分钟记录一次产生氢气的体积)。
时段 (均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
H2的体积/mL | 3.1 | 16.7 | 11.9 | 9.6 | 7.6 | 6.0 |
请解释锌与稀硫酸反应由快变慢的原因____________________________________。
(5)锌与硫酸反应的快慢可能还会受_____________因素影响,如果用实验验证该因素对反应快慢的影响,应该控制________________因素不同,而其他因素则相同。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在下列实验操作(或措施)与理由的关系中,正确的是
A. 做电解水实验时,向水中加入少量氢氧化钠溶液——氢氧化钠是催化剂
B. 探究空气中氧气含量试验中红磷要足量——充分观察磷在空气中燃烧的现象
C. 实验室制取蒸馏水时在蒸馏瓶中放入碎瓷片——加快蒸馏速度
D. 实验室用排水法收集氧气时要等气泡均匀连续放出再收集——防止收集到气体不纯
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“烧碱同学”要穿过迷宫,从进口顺利地走到出口,途中遇到不反应的物质才能通过,如图:

(1)请在答题卡中用“连续线”画出烧碱应行走的路线_________。
(2)烧碱在刚进迷宫时,就碰到了两种阻止他前进的物质。写出其中一种与其反应的化学方程式_______________________________________________。
(3)迷宫的8种物质中,俗称熟石灰的是_____________。属于盐的是__________。
(4)迷宫中Fe是常见的金属单质,若用实验证明铁比铜活泼,应选择的一组药品是_____________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为氯化钠、碳酸钠在水中的溶解度曲线。请回答下列问题:
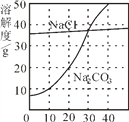
(1)20℃时,碳酸钠的溶解度为________ g;
(2)30℃时,氯化钠的溶解度 _____碳酸钠的溶解度(填写“>”、“<”或“=”);
(3)如图所示,30℃时,将盛有饱和碳酸钠溶液的小试管放入盛有30℃水的烧杯中,向水中加入某物质后,试管中有晶体析出。则加入的物质可是下面的_____(填字母序号);
A.硝酸铵 B.氢氧化钠 C.氯化钠
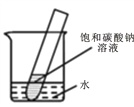
(4)10℃时,______(填“能”或“不能”)配制10%的碳酸钠溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com