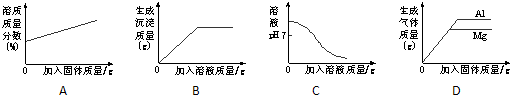
C
分析:A、一定温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体,当溶液饱和后,溶质的质量分数不再变化;
B、硫酸铜可与氢氧化钠溶液反应生成氢氧化铜沉淀,而硫酸可与氢氧化钠和氢氧化铜反应,据此分析解答;
C、氢氧化钠溶液显碱性,溶液的pH>7,加入过量的稀盐酸发生中和反应,溶液的pH不断减小;
D、等质量的金属与足量的同种酸反应,生成氢气的质量=

×金属的质量,金属活动性强的金属反应速率快.
解答:A、一定温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体,当溶液饱和后,溶质的质量分数不再变化,故图示错误;
B、硫酸铜可与氢氧化钠溶液反应生成氢氧化铜沉淀,而硫酸可与氢氧化钠和氢氧化铜反应,故溶液中有硫酸存在则不会有沉淀生成,开始无沉淀,当硫酸反应完毕才有沉淀生成,故不应从开始就有沉淀生成,错误;
C、氢氧化钠溶液显碱性,溶液的pH>7,加入过量的稀盐酸发生中和反应,溶液的pH不断减小,盐酸溶液pH<7,所以最终溶液的pH<7,图象符合变化过程,正确;
D、假设镁、铝的质量都为M,与足量稀硫酸反应后所得氯气质量分别为z、a
Mg+H
2SO
4═MgSO
4+H
2↑
24 2
M z

=

z=

M
2Al+3H
2SO
4═Al
2(SO
4)
3+3H
2↑
54 6
M a
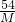
=

a=

M
=
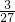
M
所以将等质量的金属镁和铝分别和质量分数相等的足量稀硫酸混合,反应产生的氢气始终铝大于镁,故图象错误;
故选C.
点评:图象题能很好的考查学生对知识的掌握和分析、解决问题的能力,因此,注重知识的积累是非常重要的,由方程式的计算可知:等质量的金属与足量的同种酸反应,生成氢气的质量=

×金属的质量,可以作为规律直接使用.

 ×金属的质量,金属活动性强的金属反应速率快.
×金属的质量,金属活动性强的金属反应速率快. =
=
 M
M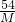 =
=
 M
M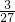 M
M ×金属的质量,可以作为规律直接使用.
×金属的质量,可以作为规律直接使用. 
