



分析 (1)根据金属的性质和用途分析判断;
(2)根据铁生锈的条件和除锈的原理分析回答;
(3)根据题意可知,含Cu、Zn铜帽与稀硫酸和氧气反应生成了硫酸铜和硫酸锌的混合液A,根据实验的目的,为了得到铜和硫酸锌,应向A溶液加入过量的锌,通过过滤得到了硫酸锌溶液和铜锌的固体混合物C,为了得到铜和硫酸锌,应加入稀硫酸,据此分析有关的问题;
(4)①根据题干中反应物、生成物,写出反应的化学方程式;
②根据过滤的原理分析回答;
(5)根据金属的活动性和金属与酸反应的质量关系分析判断.
解答 解:(1)在金属制品中,铁锅和铜导线分别利用了金属的物理性质是传热性、导电性;
(2)铁生锈的原因是铁与水、空气接触,废旧钢铁表面的铁锈可用盐酸除去,其原理是铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O.
(3)由题意可知,含Cu、Zn铜帽与稀硫酸和氧气反应生成了硫酸铜和硫酸锌的混合液A,根据实验的目的,为了得到铜和硫酸锌,应向A溶液加入过量的锌,通过过滤得到了硫酸锌溶液和铜锌的固体混合物C,为了得到铜和硫酸锌,应加入稀硫酸,所以:
①由上述分析可知,溶液A是硫酸铜和硫酸锌的混合物,固体C是铜和锌的混合物.所以,含铜、锌两种元素的有AC;
②我国早在西汉时期,就有“曾青得铁则化为铜”的记述,该反应的化学方程式可表示为:Fe+CuSO4=FeSO4+Cu.
(4)①在Ⅱ中CuS、NaCl和O2在高温条件下反应生成了CuCl2和Na2SO4,其反应的化学方程式是:CuS+2NaCl+2O2$\frac{\underline{\;高温\;}}{\;}$CuCl2+Na2SO4.
②Ⅲ的操作能将固液分开,名称是过滤,分离混合物的一般思路,首先分析混合物的组成成分,寻找各成分的差异,然后利用其差异选择合适方法进行分离,该方法就是利用混合物中不同成分颗粒的大小差异进行分离的方法.
(5)由于镁的活动性大于锌.与等质量酸反应时镁反应的时间短,所以,A是镁;由于镁、锌在化合物中的化合价相同,相对原子质量镁的较小,产生等质量的氢气,镁反应的质量较小,若反应结束后只有一种金属剩余,则剩余金属为Mg.
故答为::(1)传热性、导电性;
(2)铁与水、空气接触,Fe2O3+6HCl═2FeCl3+3H2O.
(3)①AC;②Fe+CuSO4=FeSO4+Cu.
(4)①CuS+2NaCl+2O2$\frac{\underline{\;高温\;}}{\;}$CuCl2+Na2SO4.②过滤,颗粒的大小.
(5)Mg,Mg.
点评 本题以实验设计流程的形式让学生去利用金属活动性顺序表解决有关金属化学性质的问题,有一定的难度,解题的关键是熟练运用金属活动性的顺序意义和掌握金属锈蚀的条件.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 取适量该漂白液与烧杯中,放入有色布条 | 布条没有明显变化 | 该漂白液已完全失效 |
| 实验步骤 | 预期实验现象 | 实验目的或预期结论 |
| 步骤①;取少量该漂白液于试管中,加入足量的CaCl2溶液,静置,观察 | 产生白色沉淀 | 目的: 验证并除去Na2CO3 |
| 步骤②:取上层清液于试管中,滴入无色酚酞试液,观察 | 试液变红 | 结论: 小洁猜想成立;否则,另一位同学猜想成立. |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 |  |  |  |
| 二氧化碳与水反应生成碳酸 | 与电源正极相连的玻璃管中生成的气体是氧气 | 不同物质着火点不同 | 向小试管中加入适量干冰,看到U型管中左侧液面上升、右侧液面下降 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 玻璃餐桌是当下时尚流行的元素,受到现代人的青睐,如图是一款玻璃餐桌的示意图.
玻璃餐桌是当下时尚流行的元素,受到现代人的青睐,如图是一款玻璃餐桌的示意图.查看答案和解析>>
科目:初中化学 来源: 题型:推断题
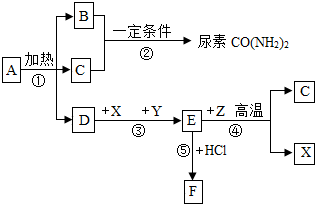 如图表示某些物质间转化关系.A为不含金属元素的盐,可作化肥,X是常见金属,B、C、Y、Z为气体,且B有刺激性气味,F为棕黄色溶液.
如图表示某些物质间转化关系.A为不含金属元素的盐,可作化肥,X是常见金属,B、C、Y、Z为气体,且B有刺激性气味,F为棕黄色溶液.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com