


分析 (1)高温条件下,碳酸钙分解生成氧化钙和二氧化碳;
浓盐酸易挥发;
浓硫酸具有吸水性,不能和二氧化碳反应,氢氧化钠和二氧化碳反应生成碳酸钠和水,氧化钙和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙和水;
(2)氯化铵中含有氮元素,可以用作氮肥;
该厂的另一种产品碳酸氢钠俗称小苏打,它的重要用途有用作发酵粉、治疗胃酸过多等;
②实验室进行“过滤”操作时,液面应低于滤纸边缘,漏斗下端的管口要紧靠烧杯内壁;
(3)碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,根据反应的化学方程式及其提供的数据可以进行相关方面的计算;
二氧化碳能够溶于水.
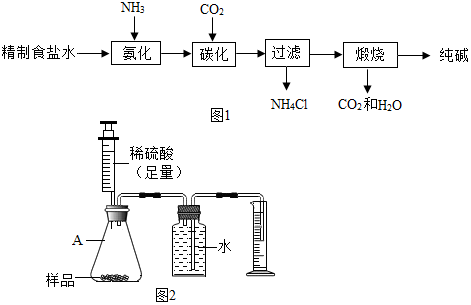
解答 解:(1)①“碳化”过程中需要的CO2,可由石灰石高温煅烧得到,该反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
故填:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
②实验室中,通常用稀盐酸与石灰石反应制取CO2气体,不选用浓盐酸的理由是浓盐酸易挥发,会导致二氧化碳中含有氯化氢气体;
干燥CO2气体,可用的干燥剂是浓硫酸,这是因为浓硫酸具有吸水性,不能和二氧化碳反应,氢氧化钠和二氧化碳反应生成碳酸钠和水,氧化钙和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙和水.
故填:浓盐酸易挥发;A.
(2)①该厂“过滤”所得的NH4Cl可作化肥中的 氮肥,该厂的另一种产品碳酸氢钠俗称小苏打,它的重要用途有用作发酵粉、治疗胃酸过多等.
故填:氮;小苏打;治疗胃酸过多.
②实验室进行“过滤”操作时,下列说法正确的有液面应低于滤纸边缘,漏斗下端的管口要紧靠烧杯内壁.
故填:BD.
(3)方案一:
解:设碳酸钠的质量为x,
BaCl2+Na2CO3═BaCO3↓+2NaCl,
106 197
x 19.70g
$\frac{106}{x}$=$\frac{197}{19.70g}$,
x=10.60g,
该厂产品中碳酸钠的质量分数为:$\frac{10.60g}{10.65g}$×100%=99.5%,
因为>99.2%,因此该厂的产品属于优等品.
方案二:
该装置中仪器A的名称是锥形瓶,但实验后同学们发现所测的碳酸钠的纯度偏低,造成此结果的原因可能是二氧化碳部分溶于水,导管中有水等.
故填:锥形瓶;二氧化碳部分溶于水,导管中有水等.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 节约资源,节能减排 | B. | 重复利用,循环再生 | ||
| C. | 低碳环保,绿色出行 | D. | 铺张浪费,相互攀比 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
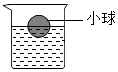 将一个塑料小球放入盛有AgNO3溶液的烧杯中,小球悬浮于液面,位置如图.将一定质量的铜片放入烧杯中,充分反应后(溶液的体积几乎不变),烧杯中出现哪些现象?写出发生的化学反应方程式.
将一个塑料小球放入盛有AgNO3溶液的烧杯中,小球悬浮于液面,位置如图.将一定质量的铜片放入烧杯中,充分反应后(溶液的体积几乎不变),烧杯中出现哪些现象?写出发生的化学反应方程式.查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com