
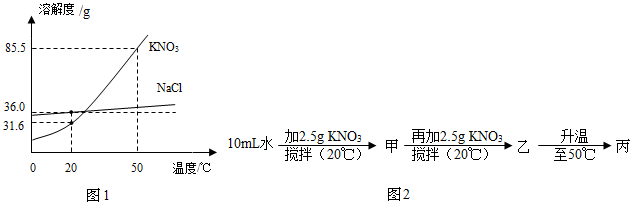
分析 根据题目信息可知:可以采用PH试纸来测定海河水的酸碱度,自制简易净水器净化海河水,其中活性炭起到吸附和过滤的作用;降低水的硬度的方法是:在生活中是加热煮沸,在实验室中是蒸馏;根据质量守恒定律,等号两边各原子的种类和数目相等,2NaClO3+4HCl═2ClO2↑+Cl2↑+2X+2NaCl中,X中有两个H原子和一个O原子;二氧化氯中氯元素的化合价为+4价,因为氧元素的化合价是-2价;根据溶解度曲线可知:硝酸钾和氯化钠两种固体物质的溶解度,都是随温度升高而增大,而硝酸钾的溶解度随温度的升高变化比氯化钠大;20℃时,KNO3的溶解度是31.6g;图2中,甲、乙、丙中为饱和溶液的是乙,并且固体有剩余;水的密度约为1g/cm3,因此水的质量=10mL×1g/mL=10g,甲的溶质的质量分数=$\frac{2.5g}{12.5g}×100%$=20%;若将甲溶液稀释到5%,则需加水的质量为x,(12.5g+x)×5%=2.5g,x=37.5g;欲除去KNO3固体中混有的少量NaCl,提纯的方法为降温结晶,因为硝酸钾的溶解度受温度的影响比氯化钠大;若将50℃时NaCl、KNO3两种物质的饱和溶液冷却至20℃,该过程中保持不变的是溶剂的质量.
解答 解:(1)根据题目信息可知:可以采用PH试纸来测定海河水的酸碱度,自制简易净水器净化海河水,其中活性炭起到吸附和过滤的作用;降低水的硬度的方法是:在生活中是加热煮沸,在实验室中是蒸馏;故答案为:①PH试纸;②吸附;③煮沸;
(2)根据质量守恒定律,等号两边各原子的种类和数目相等,2NaClO3+4HCl═2ClO2↑+Cl2↑+2X+2NaCl中,X中有两个H原子和一个O原子;二氧化氯中氯元素的化合价为+4价,因为氧元素的化合价是-2价;故答案为:H2O;+4;
(3)20℃时,KNO3的溶解度是31.6g;图2中,甲、乙、丙中为饱和溶液的是乙,并且固体有剩余;水的密度约为1g/cm3,因此水的质量=10mL×1g/mL=10g,甲的溶质的质量分数=$\frac{2.5g}{12.5g}×100%$=20%;若将甲溶液稀释到5%,则需加水的质量为x,(12.5g+x)×5%=2.5g,x=37.5g;欲除去KNO3固体中混有的少量NaCl,提纯的方法为降温结晶,因为硝酸钾的溶解度受温度的影响比氯化钠大;若将50℃时NaCl、KNO3两种物质的饱和溶液冷却至20℃,该过程中保持不变的是溶剂的质量故答案为:①31.6g;②乙;20%;37.5;③降温结晶;④B;
点评 本考点考查了溶液酸碱度的测定、硬水的软化、质量守恒定律、溶解度曲线及其应用等,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,有关的计算要准确,本考点主要出现在选择题和填空题中.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,滴加稀盐酸的质量与产生气体质量的关系如图所示.求:
取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,滴加稀盐酸的质量与产生气体质量的关系如图所示.求:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 实验室制取氧气的方法都要用到催化剂 | |
| B. | 用排水法收集和用向上排空气法收集时,验满的方法一样 | |
| C. | 用氯酸钾制取氧气的发生装置与用高锰酸钾制取氧气的发生装置一样 | |
| D. | 过氧化氢溶液和二氧化锰混合制得氧气的质量与二氧化锰的质量有关 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 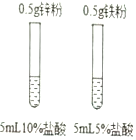 比较Zn和Fe的金属活动性强弱 比较Zn和Fe的金属活动性强弱 | B. | 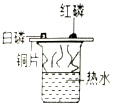 探究燃烧是否需要氧气 探究燃烧是否需要氧气 | ||
| C. | 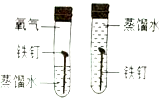 探究铁钉生锈时O2是否参与反应 探究铁钉生锈时O2是否参与反应 | D. |  测定空气中O2的含量 测定空气中O2的含量 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 烧杯底部固体一定只有Ag、Cu | |
| B. | 溶液的颜色可能是无色的 | |
| C. | 溶液中一定只有Cu(NO3)2、Zn(NO3)2 | |
| D. | 溶液质量一定小于加入锌粉前的溶液质量 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
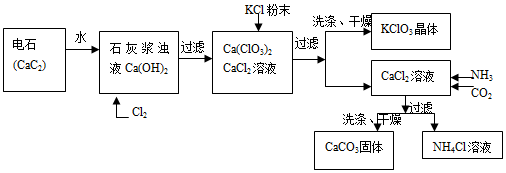
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 29.0 | 74.5 | 7.3 | 34.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 能源是国家和家庭中必不可少的.
能源是国家和家庭中必不可少的.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com