
| A. | 试管 | B. | 烧杯 | C. | 量筒 | D. | 集气瓶 |
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 大胆提出假设:氧气比氢气易溶于水 | |
| B. | 查找实验装置是否漏气 | |
| C. | 反复多次实验查找原因 | |
| D. | 实验所得数据与理论值相差不多,可以认为实验已经成功 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 植树造林,加强绿化 | B. | 合理使用化肥农药 | ||
| C. | 工业废气经处理达标后再排放 | D. | 矿物产品的综合开发和利用 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 化学反应文字表达式 | 基本反应类型 | |
| (1)硫在氧气中燃烧 | ||
| (2)碳在氧气中燃烧 | ||
| (3)铁在氧气中燃烧 | ||
| (4)过氧化氢分解制取氧气 | ||
| (5)加热氯酸钾制取氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
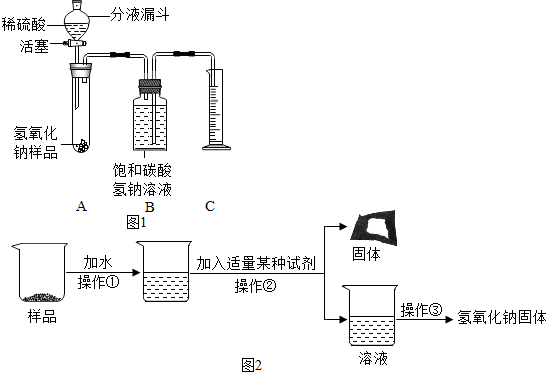
| 实验操作 | 实验现象 | 实验结论 |
| (a)取少量样品溶于水,加入过量的氯化钙溶液; | 有白色沉淀产生 | 该反应的化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl |
| (b)静置,向将上述反应后的混合液过滤,取滤液加入酚酞试液. | 溶液变红色 | 证明猜想Ⅱ成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com