



 ×100%=8.1%
×100%=8.1%

 步步高达标卷系列答案
步步高达标卷系列答案科目:初中化学 来源: 题型:
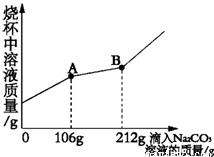
 已知Na2CO3的水溶液呈碱性,在一烧杯中盛有20.4g Na2CO3和NaCl组成的固体混合物.向其中逐渐滴加溶质质量分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题:
已知Na2CO3的水溶液呈碱性,在一烧杯中盛有20.4g Na2CO3和NaCl组成的固体混合物.向其中逐渐滴加溶质质量分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:
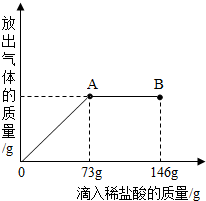
 在一烧杯中盛有42.2g CaCO3和CaCl2的粉末状混合物,向其中加入188.8g水,使混合物中的可溶物完全溶解.然后再向其中逐滴加入溶质的质量分数为10%的稀盐酸,烧杯中难溶固体物质的质量与所滴入稀盐酸的质量关系曲线如图X所示:
在一烧杯中盛有42.2g CaCO3和CaCl2的粉末状混合物,向其中加入188.8g水,使混合物中的可溶物完全溶解.然后再向其中逐滴加入溶质的质量分数为10%的稀盐酸,烧杯中难溶固体物质的质量与所滴入稀盐酸的质量关系曲线如图X所示:查看答案和解析>>
科目:初中化学 来源: 题型:
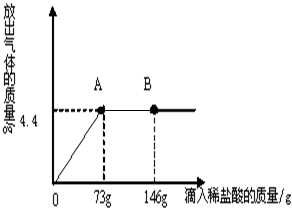
 (2010?济南)在一烧杯中盛有一定质量的氧化铜,向其中加入足量的稀硫酸,至恰好完全反应,在一定温度下得到40gCuSO4的不饱和溶液.向所得溶液中逐滴滴入溶质质量分数为10%的NaOH溶液,溶液的总质量与滴入NaOH溶液的质量的质量关系曲线如图所示.请根据题意回答下列问题:
(2010?济南)在一烧杯中盛有一定质量的氧化铜,向其中加入足量的稀硫酸,至恰好完全反应,在一定温度下得到40gCuSO4的不饱和溶液.向所得溶液中逐滴滴入溶质质量分数为10%的NaOH溶液,溶液的总质量与滴入NaOH溶液的质量的质量关系曲线如图所示.请根据题意回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.小刚叫来小军和小红,共同探究这种白色粉末的成分.
小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.小刚叫来小军和小红,共同探究这种白色粉末的成分.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com