
【题目】冶炼2000t含杂质3%的生铁,需要含Fe3O490%的磁铁矿石多少吨?
【答案】生铁中铁的质量为2000t×(1-3%)=1940t
设需四氧化三铁的质量为x,则
4CO+Fe3O4![]() 3Fe+4CO2
3Fe+4CO2
232 168
x 1940t
即![]() =
=![]()
解得x≈2679.05t
所以需磁铁矿的质量为2679.05t÷90%≈2976.72t
答:需要磁铁矿2976.72t。
【解析】试题分析:含有杂质的混合物质量的化学方程式计算,首先要明确混合物与纯净物之间的换算:混合物质量×纯净物的质量分数=纯净物的质量;纯净物的质量÷纯净物的质量分数=混合物质量,故2000t含杂质3%的生铁中铁的质量=2000t×(1-3%)=1940t,然后再根据化学方程式:Fe3O4+4CO高温3Fe+4CO2中Fe3O4与Fe的质量关系,即可求出Fe3O4的质量,进而可算出磁铁矿石的质量
解:设需要Fe3O4的质量为x
Fe3O4+4CO高温3Fe+4CO2
232 168
x 1940t
232:168=x:1940t x=2679.05t
∴需要含Fe3O490%的磁铁矿石质量=2679.05t÷90%=2976.7t


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】有一包白色粉末,可能含有氯化铵、氯化钡、碳酸钙、无水硫酸铜、氯化钠、氢氧化钠中的一种或几种。为确定其组成,进行如下实验:
①取少量该粉末置于研钵中研磨,未嗅到任何气味;
②取少量该粉末置于烧杯中,向烧杯中加入适量的水,充分搅拌,静置后,观察到上层溶液呈无色,烧杯底部有蓝白色沉淀,过滤得到滤液和滤渣;
③向上述滤液中滴加几滴硝酸银溶液,溶液变浑浊;
④向上述滤渣中加入足量稀盐酸,充分搅拌,仍有白色沉淀且其质量未减少。下列说法正确的是( )
A.白色粉末中可能有氯化钠和氢氧化钠
B.白色粉末中一定有氯化钡、氢氧化钠、无水硫酸铜
C.白色粉末中一定没有碳酸钙、氢氧化钠、氯化铵,可能有氯化钠
D.白色粉末中一定有氢氧化钠和无水硫酸铜,且二者的质量比可能为1:2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一包固体含有镁粉、碳粉、氧化铜、氢氧化钠、氯化钾中的一种或几种。为探究固体的组成,某化学兴趣小组进行了如下所示实验:
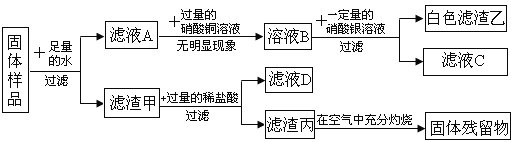
请回答下列问题:
(1)实验中生成白色滤渣乙的化学方程式为___________;
(2)原固体中一定没有的物质是______(写名称或化学式均可,下同),原因是_____________
(3)滤渣甲中一定含有的物质是____________;
(4)实验结束后,该兴趣小组将滤液C和滤液D都倒入到废液缸,有白色沉淀生成,静置后,经检验上层清液E中不含氯离子,则E中一定含有的溶质是________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某小组在实验室中探究金属钠与二氧化碳的反应,选用如图所示装置及药品进行实验。已知:
钠 | 氧化钠 | 过氧化钠(Na2O2) |
银白色固体 | 白色固体 | 淡黄色固体 |
回答下列问题:
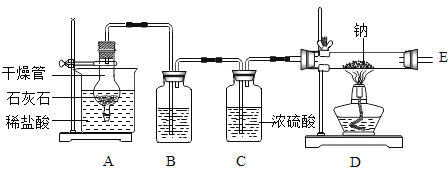
(1)打开活塞,制取CO2。为了得到干燥、纯净的CO2,B中盛有_____(填试剂名称)。反应结束后,关闭活塞,干燥管内可观察到的现象是_____ 。不能用稀硫酸代替稀盐酸,其原因是___。
(2)金属钠与二氧化碳反应的实验步骤及现象如下表:
操作步骤 | 实验现象 | |
1 | 打开活塞,待玻璃管中充满二氧化碳后,点燃酒精灯加热。 | 产生大量白烟,玻璃管壁上有黑色 固体产生。 |
2 | 冷却后,将玻璃管中的固体全部取出,并置于试管中,加入适量的蒸馏水,振荡、过滤。 | 滤纸上留下黑色物质,滤液为无色溶液。 |
①验证玻璃管中充满二氧化碳的方法是_____。
②为检验玻璃管中白色物质的成分,取适量滤液于2支试管中,向一支试管中滴加1滴酚酞溶液,溶液变红;向第二支试管中滴加氢氧化钡溶液,溶液变浑浊。据此推断,白色物质的化学式是___.(填标号)。
ANa2O BNa2O2 CNaOH DNa2CO3
③经检验,滤纸上留下的黑色固体是一种单质,请写出它能与其他黑色固体反应的化学方程式:_____________________________.(任写一个)。
④本实验中金属钠与二氧化碳反应的化学方程式为______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是一种常见的物质,在生产生活中发挥着重要的作用.
(l)把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是_____(填字母).
A 食盐 B 面粉 C 汽油 D 味精
(2)在盛有水的烧杯中加入以下某种物质,形成溶液过程中,温度上升.这种物质可能是_____(填字母).
A 硝酸铵 B 氢氧化钠 C 氯化钠 D 蔗糖
(3)甲和乙两种固体物质的溶解度曲线如图所示,回答下列问题:

①t1℃时,甲物质的溶解度是_____.
②将t2℃乙物质的不饱和溶液变成饱和溶液,其中一种可行的方法是_____(填“增加水”或“增加乙物质”)
③t3℃时将等质量的甲和乙两种物质配置成饱和溶液,需要水的质量甲_____乙(填“大于”、“小于”、“等于”)
④将等质量的t3℃时甲乙两物质的饱和溶液,降温至t2℃,析出晶体最多的是_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与人类生活息息相关,联系学过的化学知识,按要求完成下列各题。
(1)牛奶是一种优质食品,除水外,牛奶中富含的营养素是______。
(2)煤燃烧时排放的气体中,会形成酸雨的气体是______(填下列序号):
A CO B CO2 C SO2 D NO2
(3)从能源能否循环再生的角度划分,煤、石油、天然气属于______(填“可再生”或“不可再生”)能源。
(4)“芯片”是智能化电器设备的核心,主要材料是高纯度的单质硅。制备高纯度硅其中一个反应是:SiO2+2C![]() Si+2CO↑,反应前后化合价设有发生改变的元素是______(填化学式)。
Si+2CO↑,反应前后化合价设有发生改变的元素是______(填化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了测定某医用双氧水中H2O2的浓度,某兴趣小组取10g样品设计如图装置进行实验(实验在常温下进行,O2在水中的溶解情况忽略不计,密度为1.43g/L),实验数据如下:
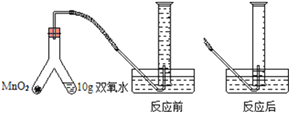
时间/s | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | 110 |
量筒 读数/mL | 0 | 32 | 60 | 80 | 90 | 95 | 98 | 100 | 98 | 94 | 90 | 90 |
(1)实验开始,将MnO2和双氧水混合,操作方法是______。
(2)反应结束,共制得氧气______mL。
(3)列式计算双氧水中H2O2的溶质质量分数___。(保留到0.01%)
(4)根据表中数据,画出产生O2的体积随时间的变化关系____;70s后测得气体体积逐渐变小的原因是:______。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据铁在空气中生锈的原理,实验小组设计了图示实验装置测定空气里氧气的含量。已 知广口瓶的有效容积为 242mL,实验 8 分钟后打开止水夹,水从烧杯流入广口瓶中的体积 为 48mL。下列说法不正确是
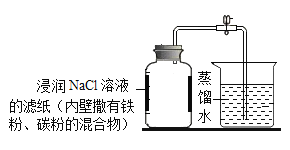
A.实验前广口瓶底部必须放入少量水B.铁生锈的主要条件是与空气和水直接接触
C.氯化钠和炭粉可能起加快铁粉生锈的作用D.本实验测得空气里氧气的体积分数约为 19.8%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水和溶液在生产生活中起着重要的作用。
(1)海水中含量最多的物质是___________________。
(2)下列做法有利于保护水资源的是___(填序号)。
A.大量使用化肥、农药 B.工业废水处理达标后排放
C.使用含磷洗衣粉 D.生活污水直接排放
(3)生活中,一般可用________的方法来使硬水转化为软水。
(4)我国研制出比漂白粉更高效的饮用水消毒剂“ClO2”,完成制取 ClO2 的反应的化学方程式: Cl2 + 2NaClO2=2ClO2 +_________。
(5)KNO3 和 NaCl 的溶解度曲线如图甲,20℃时取 18g KNO3和 18gNaCl 分别放入两只烧杯中,各加入 50mL水(水的密度 1g/mL),充分溶解,现象如图乙所示;升温到 50℃时,现象如图丙所示。请回答下列问题:
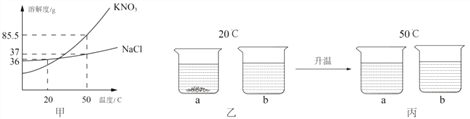
①乙图中,a 烧杯溶液中溶质的质量分数 ___________________b 烧杯溶液中溶质的质量分数(选填“>” “<”或“=”)。
②要使丙图中的 NaCl 溶液恰好变成饱和溶液,需要加入 ___________________ gNaCl 固体。
③除去固体 KNO3中混有的少量 NaCl,实验步骤:先加水加热溶解,再 ___________________ ,然后过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com