
| A. | 金属材料 | B. | 复合材料 | C. | 有机合成材料 | D. | 无机非金属材料 |
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
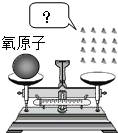 在学习相对原子质量的时候,课本上引用了如图所示的模型图.根据相对原子质量的定义,盘中的每一小块表示的是( )
在学习相对原子质量的时候,课本上引用了如图所示的模型图.根据相对原子质量的定义,盘中的每一小块表示的是( )| A. | 一个碳原子质量的 $\frac{1}{12}$ | B. | 一个氧原子质量的 $\frac{1}{16}$ | ||
| C. | 一个碳原子的质量 | D. | 一个氢原子的质量 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 2015年2月,中德科学家成功合成了具有优异的电化学性能的钒的氧化物(V6O13),钒元素的相关信息如图.下列有关钒的说法错误的是( )
2015年2月,中德科学家成功合成了具有优异的电化学性能的钒的氧化物(V6O13),钒元素的相关信息如图.下列有关钒的说法错误的是( )| A. | 原子的核外电子数是23 | B. | 原子核内的中子数是28 | ||
| C. | 相对原子质量为50.94 | D. | 属于稀有气体元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 20℃ | 8%Na2CO3溶液 | 8%NaHCO3溶液 |
| pH | 10.6 | 8.0 |
| 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
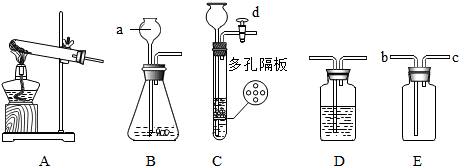
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入适量盐酸,塞上带导管的单孔塞 把导管插入另一试管里的石灰水中. | 有气体产生,气体使石灰水变浑浊. | 猜想2成立 |
| ②在上述反应后的试管中加少量品红溶液. | 品红溶液褪色. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
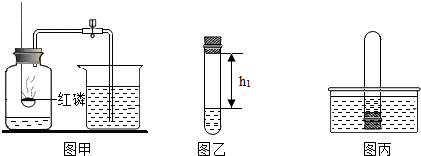
| 第1次 | 第2次 | 第3次 | |
| h1/厘米 | 11.0 | 11.4 | 11.6 |
| h2/厘米 | 8.7 | 9.1 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com