
分析 根据A3+是A原子失去3个电子得到的,结合A3+的核外有23个电子,核内有30个中子,原子中相对原子质量=质子数+中子数,进行分析解答;
根据已有的知识进行分析,原子中,核内质子数=核外电子数,相对原子质量=质子数+中子数,据此解答.
解答 解:A3+是A原子失去3个电子得到的,A3+的核外有a个电子,则A原子的质子数为a+3.
核内质子数等于中子数故核内有a+3个中子,原子中相对原子质量=质子数+中子数,则该元素原子的相对原子质量是a+3+a+3=2a+6.
故填:2a+6.
元素B2-核外有x个电子,则B原子中含有x-2个电子,故核内的质子数=x-n,相对原子质量=质子数+中子数,故中子数=y-x+2,故填:y-x+2.
点评 本题难度不大,掌握原子和离子的相互转化、原子中相对原子质量=质子数+中子数是正确解答本题的关键.


科目:初中化学 来源: 题型:实验探究题
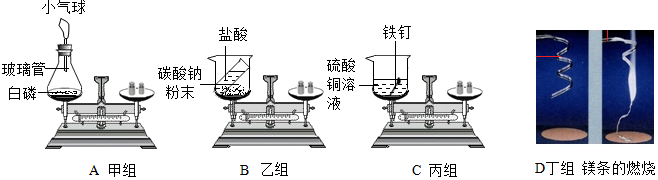
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 甲基叔丁基醚属于化合物 | |
| B. | 甲基叔丁基醚的相对分子质量为88 | |
| C. | 甲基叔丁基醚中碳元素的质量分数约为68.2% | |
| D. | 一个甲基叔丁基醚分子是由5个碳原子、9个氢原子和1个氧原子构成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 据图回答:
据图回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 浸洗前后,被浸洗的粗盐中氯化镁的含量基本不变 | |
| B. | 浸洗前后,饱和食盐水中氯化钠的质量基本不变 | |
| C. | 浸洗用的饱和食盐水可以无数次的使用下去 | |
| D. | 浸洗后,食盐水中氯化钠的质量增大 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
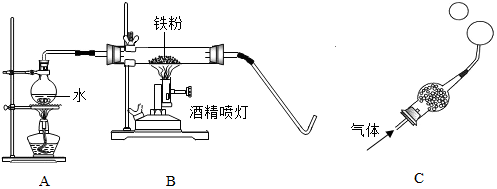
| 实验操作 | 实验现象及结论 |
| 取少量黑色固体于试管中,加入足量稀盐酸 | 无气泡产生,黑色固体是Fe3O4 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 所取合金的质量∕g | 10 | 10 | 20 | 30 |
| 所加稀硫酸的质量∕g | 100 | 120 | 80 | X |
| 生成氢气的质量∕g | 0.2 | 0.2 | 0.2 | Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com