(2012?潍坊)反思、归纳与提升是化学学习的重要方法.对于复分解反应及其规律,通过反思与探索,同学们有了新的认识.请填写下文中横线上的空白.
【知识回顾】
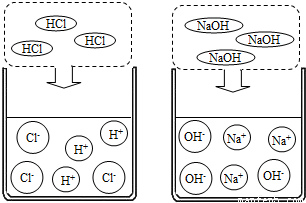
①氯化氢气体、氢氧化钠固体不导电.
②盐酸、氢氧化钠溶液能导电

【分析归纳】
氯化氢溶于水:HCl→H
++Cl
-氢氧化钠溶于水:NaOH→Na
++OH
-结论:溶液导电是由于溶液中存在自由移动的离子.
【迁移运用】硫酸钠溶液能导电,原因是硫酸钠溶于水:Na
2SO
4→
2Na++SO42-
2Na++SO42-
.
【探索发现】
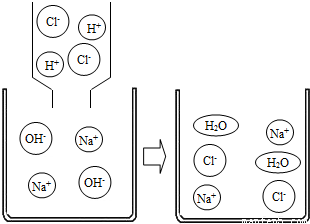
(1)氢氧化钠溶液与盐酸反应的微观示意图

【分析归纳】
反应的化学方程式:
NaOH+HCl=NaCl+H20
NaOH+HCl=NaCl+H20
.
反应的实质:H
++OH
-→H
2O,反应能进行的原因是溶液中H
+和OH
-的数目减少,即自由移动的粒子数目减少.
(2)硫酸钠溶液跟氯化钡溶液反应的微观示意图

【分析归纳】
反应的化学方程式:
BaCl2+Na2SO4=BaS04↓+2NaCl
BaCl2+Na2SO4=BaS04↓+2NaCl
.
反应的实质:(略).
反应能进行的原因是溶液中
Ba2+和SO42-
Ba2+和SO42-
的数目减少,即自由移动的离子数目减少.
(提示:生成硫酸钡白色沉淀)
(3)有气体生成的复分解反应,以Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑为例,反应实质:2H
++CO
32-→
H20+CO2↑
H20+CO2↑
.
【总结规律】
上述复分解反应能发生的本质原因
溶液中自由移动的离子的数目减少
溶液中自由移动的离子的数目减少
.