
| A | ①食品包装填充氧气--防止变质、变形 ②湿衣服在夏天比在冬天更快晾干-分子间有间隔 | B | ①H2、CH4都是可燃气体--点燃前 须检验纯度 ②墙内开花墙外香--分子不断运动 |
| C | ①要积极植树造林---保护空气,减少污染 ②自来水消毒剂ClO2中氯元素的化合价为1价 | D | ①少用塑料购物袋--有利于减少“白色污染” ②工业上用分离液态空气法制氧气发生了化学反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、根据氧气的化学性质进行分析;根据分子是在不断运动进行分析;
B、根据气体的性质,分子的运动等知识进行分析;
C、根据防治空气污染的措施进行分析;根据化合物中元素的化合价等知识进行分析;
D、根据塑料是造成“白色污染”的主要途径进行分析;根据有新物质生成的变化叫化学变化,没有新物质生成的变化叫物理变化进行分析;
解答 解:A、氧气是一种化学性质比较活泼的气体,能够和食品反应,导致食物变质;湿衣服在夏天比在冬天容易晾干,是因为夏天气温高,分子的运功速率随温度升高而加快;故A错误;
B、H2、CH4都是可燃气体,不纯易引起爆炸,点燃前须检验纯度;墙内开花墙外香,说明了分子不断运动;故B正确;
C、积极植树造林,有利于保护大气,防治空气污染;ClO2中氯元素的化合价是+4价,故C错误;
D、由于塑料很难降解,所以废弃塑料会形成白色污染;分离液态空气法制氧气没有新物质生成,属于物理变化;故D错误;
故选B.
点评 本题考查全面,重在基础,教育学生注意知识的积累,解决此题可依据已有知识进行.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子在不断运动 | B. | 分子的质量很小 | C. | 分子之间有间隔 | D. | 分子的体积很小 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质 | 甲 | 乙 | 丙 |  --氮原子 --氮原子 --氢原子 --氢原子 |
| 微观示意图 |  |  |  |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
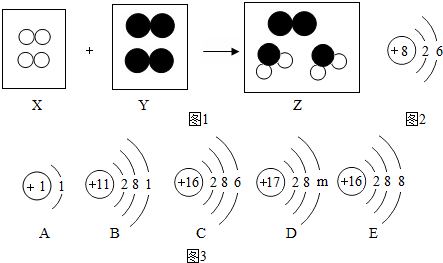
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
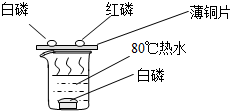
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 金属种类 | 锰(Mn) | 镁 | 铜 |
| 与盐酸反应 | 略慢 | 快 | 无明显现象 |
| 等质量的金属(a克)与足量盐酸反应 | 镁 | 铁 | 锰 |
| 金属的相对原子质量 | 24 | 56 | 55 |
| 产生氢气的质量(g) | $\frac{a}{12}$ | $\frac{a}{28}$ | $\frac{a}{27.5}$ |
| 找到的规律 | 化合价相同的情况下,相对原子质量越大产生的氢气质量越小 (只描述规律,不写前提) | ||
| 实验目的 | 实验操作 | 实验现象和结论 |
| 探究Mn和Cu的金属活动性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com