
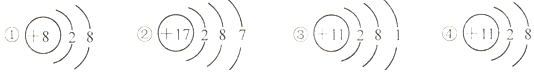
| A. | ①的化学性质比较稳定 | B. | ③④属于同种元素 | ||
| C. | ②容易得到电子 | D. | ④是一种阴离子 |
分析 A、若粒子的最外层电子数为8(氦为2个),属于相对稳定结构.
B、元素是质子数(即核电荷数)相同的一类原子的总称,同种元素的粒子是质子数相同,据此进行分析判断.
C、若原子的最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子.
D、当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子.
解答 解:A、①的最外层电子数为8,化学性质比较稳定,故选项说法正确.
B.元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),③④的质子数相同,属于同种元素,故选项说法正确;
C、②的最外层电子数是7,大于4,在化学反应中易得到1个电子而形成阴离子,故选项说法正确.
D、④质子数=11,核外电子数=10,质子数>核外电子数,为阳离子,故选项说法错误.
故选:D.
点评 本题难度不大,考查学生对粒子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.


科目:初中化学 来源: 题型:计算题
| 加入氢氧化钠的质量/g | 1.0 | 8.0 | 9.5 | 10.0 | 10.5 |
| 烧杯中溶液的pH | 1.3 | 2.0 | 3.9 | 7.0 | 9.9 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 淡化海水可解决淡水紧缺问题 | |
| B. | 长期饮用蒸馏水对人体的健康有利 | |
| C. | 任何溶液的溶剂都是水 | |
| D. | 水中Ca2+、Mg2+增多导致水体富营养化 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
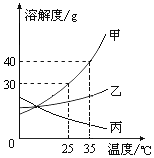 甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
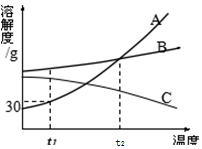 如图是A.B.C三种物质的溶解度曲线,据图回答:
如图是A.B.C三种物质的溶解度曲线,据图回答:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 温度/℃ | 0 | 20 | 40 | 50 | 60 | 80 |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 145 | 110 | 169 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
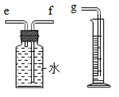 化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.| 编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| 1 | 20% | 锌粒 | 31.7 |
| 2 | 20% | 锌片 | 50.9 |
| 3 | 30% | 锌粒 | 61.7 |
| 4 | 30% | 锌片 | 79.9 |
| 时段 (均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积/mL | 3.1 | 16.7 | 11.9 | 9.6 | 7.6 | 6.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Mg+O2$\frac{\underline{\;点燃\;}}{\;}$MgO2 | B. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | ||
| C. | CO2+Ca(OH)2═CaCO3+H2O | D. | NH4HCO3$\frac{\underline{\;加热\;}}{\;}$NH3↑+CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com