
【题目】化学是一门以实验为基础的学科。
【实验一】常见气体的制取
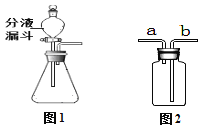
(1)若用图1装置制取氧气,则装置中发生反应的化学方程式是__________________.
(2)若用图1装置制取二氧化碳,则在锥形瓶中盛放______(填名称),装置中发生反应的化学方程式是____________.
【实验二】图2装置有多种用途
(3)收集气体:排空气法收集气体,气体从a端进入,该气体必须具有的性质是____.
(4)干燥气体:除去二氧化碳中的水蒸气,则装置中应盛放________(填“浓硫酸”或“NaOH溶液”)。
(5)贮存气体:用水将瓶中贮存的气体排出使用,水从___(填“a”或“b”)端进入。
【实验三】控制变量法是实验探究的重要方法
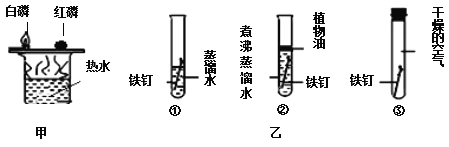
(6)上图甲中比较铜片上白磷和红磷的不同现象可以说明可燃物燃烧需要________。
(7)上图乙中①②③对比可以探究铁的锈蚀与_______、_____有关。
【答案】 2H2O2 MnO2 2H2O +O2↑ 石灰石或大理石(“碳酸钙”不得分); CaCO3+2HCl==CaCl2+H2O+CO2↑ 密度比空气小 浓硫酸 b 温度达到可燃物的着火点(无“温度”不得分) 氧气、 水
【解析】根据所学知识和题中信息知,【实验一】常见气体的制取。(1)若用图1装置制取氧气,固体和液体或液体和液体反应,不需加热制取气体,则装置中发生反应的化学方程式是2H2O2 ![]() 2H2O +O2↑。(2)若用图1装置制取二氧化碳,则在锥形瓶中盛放石灰石或大理石,装置中发生反应的化学方程式是CaCO3+2HCl==CaCl2+H2O+CO2↑。【实验二】图2装置有多种用途。(3)收集气体:排空气法收集气体,气体从a端进入,a端导管伸出较短,b端导管伸出较长,该气体必须具有的性质是密度比空气小。(4)干燥气体:除去二氧化碳中的水蒸气,则装置中应盛放浓硫酸,浓硫酸具有吸水性,并且不与二氧化碳反应。5)贮存气体:用水将瓶中贮存的气体排出使用,水从b端进入。【实验三】控制变量法是实验探究的重要方法。(6)甲中比较铜片上白磷和红磷的不同现象可以说明可燃物燃烧需要温度达到可燃物的着火点。(7)乙中①②③对比可以探究铁的锈蚀与氧气、水有关。
2H2O +O2↑。(2)若用图1装置制取二氧化碳,则在锥形瓶中盛放石灰石或大理石,装置中发生反应的化学方程式是CaCO3+2HCl==CaCl2+H2O+CO2↑。【实验二】图2装置有多种用途。(3)收集气体:排空气法收集气体,气体从a端进入,a端导管伸出较短,b端导管伸出较长,该气体必须具有的性质是密度比空气小。(4)干燥气体:除去二氧化碳中的水蒸气,则装置中应盛放浓硫酸,浓硫酸具有吸水性,并且不与二氧化碳反应。5)贮存气体:用水将瓶中贮存的气体排出使用,水从b端进入。【实验三】控制变量法是实验探究的重要方法。(6)甲中比较铜片上白磷和红磷的不同现象可以说明可燃物燃烧需要温度达到可燃物的着火点。(7)乙中①②③对比可以探究铁的锈蚀与氧气、水有关。
点睛∶燃烧需要同时满足两个条件⑴可燃物与空气接触⑵温度达到可燃物的着火点。根据反应物状态和反应条件选择气体制取装置,根据生成气体的溶解性和密度选择气体的收集方法。


科目:初中化学 来源: 题型:
【题目】化学实验是学好化学的基础,某校学生进行了以下化学实验:
Ⅰ.甲小组利用下列几种发生装置和收集装置制取O2。请回答下列问题:
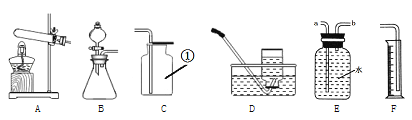
(1)写出标号①的仪器名称_______
(2)实验室用双氧水和和二氧化锰制取并收集较纯的氧气时,选用的装置是________(填字母),二氧化锰的作用是________。写出该反应的化学方程式_________________________。
(3)将右侧E和F装置连接,可测量氧气体积,氧气应从_______(填“a”或b)口通入。
Ⅱ.乙小组的同学对一包在空气中敵口放置了一段时间的碱石灰的成分进行探究。
【提出问题】这包久置的碱石灰样品的成分是什么?
【查阅资料}】①碱石灰是由CaO和NaOH固体混合而成,通常用于吸收二氧化碳及干燥气体。②熟石灰固体溶解度小,溶于水放出的热量少,可以忽路不计。
【提出猜想】该碱石灰的主要成分可能含有CaO、NaOH、 Na2CO3、 CaCO3和_______等五种物质。
【实验探究】小组的同学设计实验并进行验证,过程如下:
①小明取部分该碱石灰样品于试管中,加少量水后无放热现象,说明这包碱石灰样品中不含CaO和_______。继续加足量水,振荡,静置后有白色沉淀。
②从小明的试管中取上层清液于另一试管中,向其中滴加过量BaCl2溶液,有白色沉淀生成。
③把过程②所得物质过滤,向滤液中滴加无色酚酞溶液,溶液变成红色。
【思考分析】①上述实验步骤①中所得白色沉淀为_______。
②证明上述实验步骤②中加入的BaCl2溶液已过量的方法是___________________。
③若向上述实验步骤③中改滴紫色石蕊试液,观观察到的现象为 _______________。
【解释结论】该碱石灰样品中一定含有的物质是_____________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为探究铁、铜、银三种金属的活动性顺序,设计了A、B两个方案。
方案A | 方案B |
|
|
(1)能验证三种金属活动性顺序的方案是________(填“A”或“B”)。
(2)方案B中,证明铁的活动性比铜强的现象是___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。工业上从海水中可提取许多广泛应用于生活、生产、科技等方面的物质和原料。
Ι.从海水中获得淡水
下列方法常用于海水淡化的是____________(填字母)。
A.蒸馏法 B.吸附法 C.沉淀法 D.过滤法
Ⅱ.从海水中提取溴(Br2)
工业上通常是将氯气通入海水晒盐后的母液中,将溶液中的溴化钠(NaBr)转化为溴单质(Br2),然后鼓入热空气,使溴单质(Br2)从溶液中挥发出来,冷凝后得到粗溴。该过程中主要反应的化学方程式为_______________________,其反应类型是______________。
Ⅲ.从海水中提取金属镁
镁及其合金是一种用途很广的金属材料,工业上从海水晒盐后的母液中提取镁的主要流程如下:
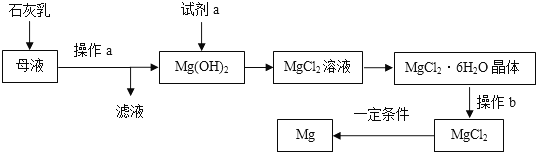
试回答下列问题:
(1)石灰乳主要成分的化学式为_____________。
(2)Mg(OH)2中加入试剂a发生反应的化学方程式为____________________________。
(3)操作b是在HCl气体氛围中高温灼烧进行的。若直接灼烧MgCl2·6H2O晶体,则生成MgO和另外两种化合物,写出有关反应的化学方程式___________________________ 。
Ⅳ.以海水中提取的食盐为原料制备纯碱
制备过程中主要涉及以下三步反应:
① CO2+NH3+H2O ══NH4HCO3
② NH4HCO3 + NaCl══NaHCO3 ↓ + NH4Cl
③ 2NaHCO3 ![]() Na2CO3+ CO2 ↑ + H2O
Na2CO3+ CO2 ↑ + H2O
试回答下列问题:
(1)制备过程中可以直接循环回收利用的物质是H2O和__________________。
(2)在实验室里证明反应③中的NaHCO3已完全分解的具体操作是________。
(3)某化学兴趣小组认为,在碳酸氢钠完全分解的情况下,所得的纯碱中也会混有来自反应②中的杂质,为此他们进行了如下探究:
a.取2.2g纯碱样品,加水完全溶解得100g溶液;
b.配制100g 3.65%的稀盐酸;
c.取上述一种溶液25g于锥形瓶中,再将另一种溶液逐滴加入锥形瓶内,反应后溶液的pH变化情况如下图所示。
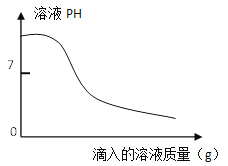
步骤c中当滴入另一种溶液为10g时,锥形瓶内物质恰好完全反应。则纯碱样品中碳酸钠的质量分数为___________(写出计算过程,计算结果保留1位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组的同学欲测定实验室中某黄铜(铜锌合金)样品中铜的质量分数(不考虑黄铜中的其他杂质,请你参与他们的探究过程。称量10 g粉末状黄铜样品放入烧杯中,量取45 mL稀盐酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀盐酸的体积(mL) | 15 | 15 | 15 |
生成氢气的质量(g) | 0.04 | m | 0.02 |
试求:
(1)求m的数值。m=_________
(2)求此黄铜样品中铜的质量分数________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2016年12月26日,合肥地铁一号线正式通车,实现了我省地下交通的新突破.根据如图回答下列问题:

(1)图中所示材料中,属于金属材料的是_____(填一种即可,下同);属于有机合成材料的是___;石墨电刷的使用主要利用其_________性.地铁车身的表面都喷上一层油漆,目的是为了防止铁与空气中的_______________发生反应而生锈.
(2)冶炼金属钛时,将钛铁矿石转化为TiCl4,TiCl4再与Na在一定条件下反应生成Ti和NaCl.请写出后一步反应的化学方程式:________________________________(不要求标出反应条件).
(3)轨道交通的发展减轻了公共交通及私家车带来的拥堵问题,从化学的角度来看,你认为发展轨道交通还有什么好处?_____________________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
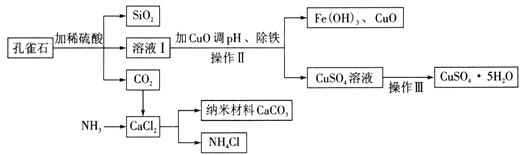
【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4 5H2O及纳米材料CaCO3,步骤如下:
请回答下列问题:
(1)写出Cu2(OH)2CO3与稀硫酸反应的化学方程式:________ 。
(2)操作Ⅱ的名称为 __________ 。
(3)由CuSO4溶液获得CuSO45H2O,需要经过蒸发浓缩、_______ 、过滤、洗涤、干燥等操作。在实验室进行“蒸发浓缩”时,除铁架台、蒸发皿、酒精灯外,还用到另一玻璃仪器,该仪器是_________。
(4)制备纳米材料CaCO3时,应向CaCl2溶液中先通入NH3,后通入CO2。请写出该反应的化学方程式:_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了达到相应的实验目的,下列实验设计部不合理的是
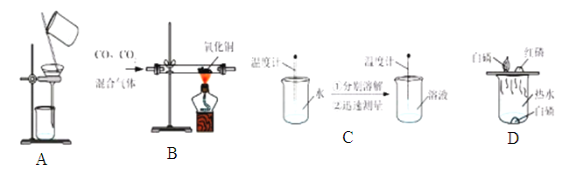
A.分离H2O2和MnO2制O2后的固液混合物 B.除去CO中的CO2气体
C.区分NaCl、NH4NO3、NaOH三种固体 D.探究可燃物燃烧的条件
查看答案和解析>>
科目:初中化学 来源: 题型:
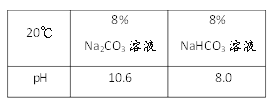
【题目】同学们对制作糕点常用膨松剂Na2CO3或NaHCO3进行了下列探究。
【查阅资料】
溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
【探究一】NaHCO3和Na2CO3性质差异的探究
(1)现有20℃时溶质质量分数为8%的Na2CO3和NaHCO3溶液酸碱性:取样于试管中,分别滴加紫色石蕊试液,均显_____色;酸碱度:NaHCO3溶液________Na2CO3溶液(填“>”或”“<”)。
(2)稳定性:按下图,实验中可观察乙烧杯中的石灰水变浑浊,甲烧杯不变,则乙烧杯中发生反应的化学方程式为:___________________________。结论:在受热条件下,碳酸钠比碳酸氢钠稳定性______(填“强”或“弱”)。
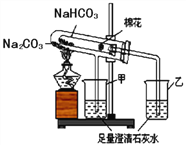
(3)利用溶解度鉴别NaHCO3和Na2CO3:分别取Xg两种固体粉末加入20℃,10g水中充分溶解,通过观察溶解现象来区分,X可以是下列的_______。(选填A、B或C)
A.1.5g B.0.96g C.0.5g
【探究二】测定NaHCO3和Na2CO3混合物10.0g中NaHCO3的质量分数(下图,夹持装置略)
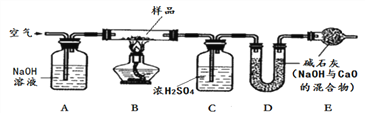
【问题讨论】
(4)实验前先通一段时间的空气的目的是____________________;
(5)A的作用是_____________________________,若没有装置E,NaHCO3的质量分数测定结果会_____________(填“偏大”、“不变”或“偏小”)。
(6)停止加热后,仍继续通入空气一段时间,目的是___________________。
【含量测定】
(7)测得装置D的质量实验前为120.2g,实验后为122.4g,计算该样品中NaHCO3的质量分数。(要有计算过程)______________________
【知识拓展】
(8)向饱和的氯化钠溶液中通入氨气和二氧化碳,经过一系列变化,也可制得Na2CO3和一种铵盐。该反应的化学反应方程式为:_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com