某化学兴趣小组的同学利用如图1装置进行实验室制取气体的探究.
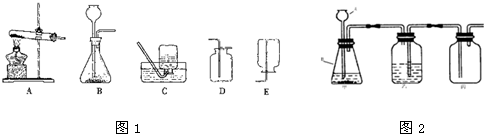
请你参与探究并回答下列问题.
(1)用A、D组合,可以制取一种气体,其反应的化学方程式是
;
从反应物的状态、反应条件等方面总结选择该发生装置需满足的一般条件
反应物为固体且反应需要加热
反应物为固体且反应需要加热
.
(2)该兴趣小组的同学设计如图2实验装置进行气体的制取与收集实验.
①写出图中有标号仪器的名称:A
长颈漏斗
长颈漏斗
.
②装置有一处设计明显错误,请指出并改正:
乙中气体从短管进,长管出;应从长导管进入,短导管出
乙中气体从短管进,长管出;应从长导管进入,短导管出
.
③用改正后的装置进行如下实验:
李军同学想利用该装置制取和收集干燥纯净的氧气,写出甲中反应的化学方程式:
,乙中物质应为
浓硫酸
浓硫酸
,检验气体是否集满的方法是
将带火星的木条放在丙装置右端管口处,若木条复燃说明收集满了
将带火星的木条放在丙装置右端管口处,若木条复燃说明收集满了
.
小芳和小明想利用上述改正后装置制取干燥的H
2和CO
2,请对他们的方案给予评价.
| 制取的气体 |
甲中盛放的试剂 |
乙中盛放的试剂 |
评价(回答是否可行,若不可行说明理由) |
| H2 |
锌粒和稀硫酸 |
浓H2SO4 |
不可行,因为氢气的密度比空气小,应用向下排空气法收集 不可行,因为氢气的密度比空气小,应用向下排空气法收集 |
| CO2 |
大理石和稀盐酸 |
浓NaOH溶液 |
不可行,因为二氧化碳与氢氧化钠溶液可反应,收集不到气体 不可行,因为二氧化碳与氢氧化钠溶液可反应,收集不到气体 |

 智慧小复习系列答案
智慧小复习系列答案

 某化学兴趣小组的同学在探究金属铜的化学性质时,发现铜与稀硫酸在常温或短时间加热的条件下均不反应.那么铜与浓硫酸能否发生反应?他们设计了如图所示装置进行探究.
某化学兴趣小组的同学在探究金属铜的化学性质时,发现铜与稀硫酸在常温或短时间加热的条件下均不反应.那么铜与浓硫酸能否发生反应?他们设计了如图所示装置进行探究.