
| 反应前物质的质量/g | 充分反应后物质的质量/g | |
| 过氧化氢溶液 | 二氧化锰 | 固体与液体混合物质量 |
| 68.0 | 0.1 | 66.5 |
分析 根据过氧化氢的化学式可以计算氢元素和氧元素质量比;
过氧化氢在二氧化锰催化作用下分解生成水和氧气,反应前后的质量差即为反应生成氧气的质量,根据氧气质量可以计算过氧化氢质量,进一步可以计算所用过氧化氢溶液的溶质质量分数.
解答 解:(1)过氧化氢中,氢元素与氧元素的质量之比为(1×2):(16×2)=1:16.
故填:1:16.
(1)该同学制得氧气的质量为:68.0g+0.1g-66.5g=1.6g.
故填:1.6g.
(2)设过氧化氢质量为x,
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
68 32
x 1.6g
$\frac{68}{x}$=$\frac{32}{1.6g}$,
x=3.4g,
该同学所用过氧化氢溶液的溶质质量分数为:$\frac{3.4g}{68.0g}$×100%=5%,
答:该同学所用过氧化氢溶液的溶质质量分数为5%.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.


 走进文言文系列答案
走进文言文系列答案科目:初中化学 来源: 题型:填空题
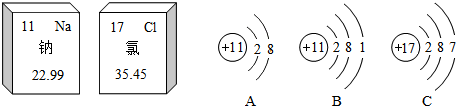
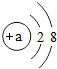 ,当a=9时,该粒子是阴离子(填“原子”、“阳离子”、或“阴离子”).该元素的化学性质与上面哪种元素的化学性质最相似?C(填序号),它属于非金属元素(填“金属“或“非金属“),当a=10时,该粒子是原子.
,当a=9时,该粒子是阴离子(填“原子”、“阳离子”、或“阴离子”).该元素的化学性质与上面哪种元素的化学性质最相似?C(填序号),它属于非金属元素(填“金属“或“非金属“),当a=10时,该粒子是原子.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
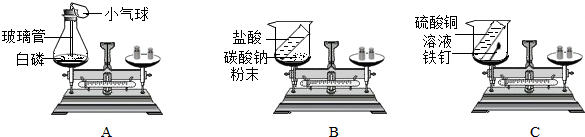
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
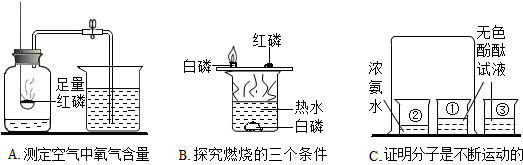
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com