
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量的熟石灰样品于烧杯中,加适量的水充分溶解后过滤。 向滤液中加入适量的 溶液; (2)向滤出固体中加入适量 。 | (1) ; (2) 。 | 猜想正确 |
| (1)酚酞 | 酚酞溶液变红,说明样品中含有氢氧化钙; |
| (2)稀盐酸 | 有气泡冒出 |


 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:初中化学 来源:不详 题型:实验题

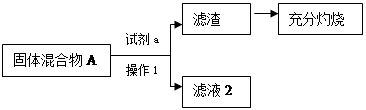
 (1)小王同学认为试剂a为水,你认为能不能实现实验目的?答: 。
(1)小王同学认为试剂a为水,你认为能不能实现实验目的?答: 。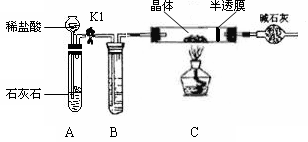
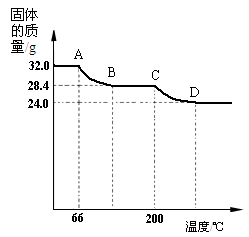
 ZnSO4 + xH2O),冷却至常温后,称量玻璃管中固体其质量为16.1g。
ZnSO4 + xH2O),冷却至常温后,称量玻璃管中固体其质量为16.1g。| A.浓硫酸 | B.硝酸银溶液 | C.饱和碳酸钠溶液 | D.澄清石灰水 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
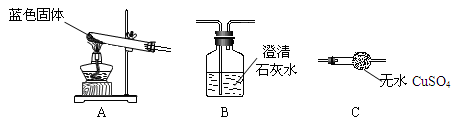
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题


查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

 三位同学利用电子天平共同作了以下测定实验,并记录如下实验数据。
三位同学利用电子天平共同作了以下测定实验,并记录如下实验数据。| 称量项目 | 称量时间 | 质量(g) |
| 试样 | ———— | 10.00 |
| 装置+稀硫酸质量 | ———— | 241.20 |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 249.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 249.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 249.00 |


查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 金属 | 空气 | 稀硫酸 | 硝酸银溶液 |
| 铁 | - | √ | √ |
| 铜 | - | - | √ |
| 镁 | √ | √ | √ |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
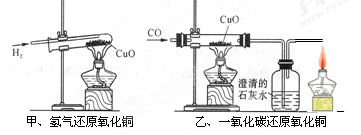
| A.实验时都应该先通入气体后加热,防止发生爆炸 |
| B.两者都可以通过观察黑色固体颜色的变化判断反应是否发生 |
| C.甲无尾气处理装置而乙有,是因为一氧化碳有毒而氢气无毒 |
| D.甲试管口略向下倾斜,乙玻璃管保持水平,是因为两种气体的密度不同 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

| 实验编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 30% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com