
| A. | 烧碱( Na2CO3) | B. | 熟石灰 (CaO) | ||
| C. | 硫酸铁 (FeSO4) | D. | 硫酸铜晶体(CuSO4•5H2O) |
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 反应物 | B. | 生成物 | C. | 催化剂 | D. | 消毒剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
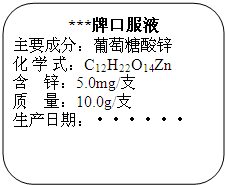 儿童缺锌会引起食欲不振、发育不良.如图为某种补锌口服液说明书的一部分,请回答:
儿童缺锌会引起食欲不振、发育不良.如图为某种补锌口服液说明书的一部分,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 小明同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.
小明同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.
| 实验操作 | 主要实验现象 | 结论 |
| ① | 证明溶液中有Na2CO3 | |
| ② | 证明溶液中既无NaHCO3又无NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com