
分析 (一)1、根据金属的活动性顺序来分析;
2、根据材料的分类、化学方程式的写法以及防锈措施来分析;
(二)1、根据基本反应类型的判断方法以及氢气的检验方法来分析;
2、根据反应原理以及化学方程式的写法来分析解答;
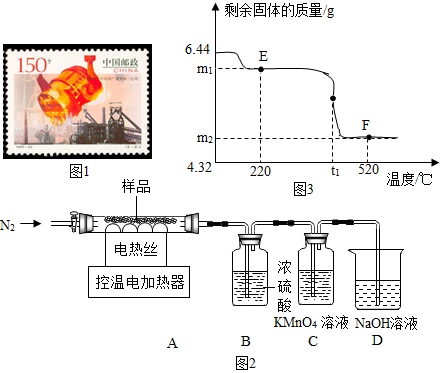
(三)根据加热前装置内有空气来分析;根据高锰酸钾具有氧化性来分析;根据2FeSO4•2Fe(OH)2•Fe2O3中的氢氧化亚铁分解为FeO来分析;根据FeSO4的质量来计算Fe2O3的质量;根据题干信息来分析解答.
解答 解:(一)1、Cu、Fe、Al三种金属的活动性由强到弱的顺序是Al、Fe、Cu;故填:Al、Fe、Cu;
2、①钢和生铁属于金属材料、聚乙烯塑料属于有机合成材料,不包括无机非金属材料;故填:B;
②用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
③铁生锈的条件是与氧气和水共同接触,只要将铁制品与水或氧气隔绝就行了,所以在铁制品表面涂油、喷漆即可;故填:涂油(答案合理即可);
(二)1、铁与稀硫酸反应生成硫酸亚铁和氢气,是由一种单质与一种化合物反应生成新的单质与新的化合物,属于置换反应,氢气具有可燃性,若不纯点燃可能会发生爆炸,所以点燃氢气之前,一定要验纯;故填:置换反应;验纯;
2、①硫酸亚铁与氢氧化钠发生复分解反应生成氢氧化亚铁和硫酸钠;故填:2NaOH+FeSO4=Fe(OH)2↓+Na2SO4;
②氢氧化亚铁、水与氧气反应生成氢氧化铁;故填:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③若没有洗净则洗涤液中含有亚铁离子,可取少量洗涤液于试管中,滴加氢氧化钠溶液,若出现白色沉淀则没有洗净,否则就洗净了;故填:取少量洗涤液于试管中,滴加氢氧化钠溶液,没有明显变化;
(三)1、加热前,通入一段时间N2的目的是将装置内的空气赶出,故填:将装置内的空气赶出;
2、高锰酸钾具有氧化性,能吸收二氧化硫,溶液由紫红色变浅,故填:紫红色的溶液颜色慢慢变浅;
①图3中E点对应的m1为2FeSO4•2Fe(OH)2•Fe2O3中的氢氧化亚铁分解为FeO后剩余固体的质量,设生成水的质量为x
2FeSO4•2Fe(OH)2•Fe2O3--2H2O
644 36
6.44g x
$\frac{644}{36}=\frac{6.44g}{x}$
x=0.36g
则m1=6.44g-0.36g=6.08g;故填:6.08;
②设生成Fe2O3的质量为y,
6.44g2FeSO4•2Fe(OH)2•Fe2O3中含有FeSO4的质量为:6.44g×$\frac{152×2}{644}×100%$=3.04g
6.44g2FeSO4•2Fe(OH)2•Fe2O3中含有Fe2O3的质量为:6.44g×$\frac{160}{644}×100%$=1.6g
2FeSO4$\frac{\underline{\;450℃~500℃\;}}{\;}$Fe2O3+SO2↑+SO3↑
304 160
3.04g y
$\frac{304}{160}=\frac{3.04g}{y}$
图3中F点对应物质中Fe2O3的质量为1.6g+1.6g=3.2g;故填:3.2;
③氧化铁与氧化亚铁在高温的条件下反应生成了四氧化三铁;故填:Fe2O3+FeO$\frac{\underline{\;高温\;}}{\;}$Fe3O4.
点评 本题综合考查了金属的活动性、材料的分类、金属的冶炼、金属的防锈、物质的制备,具有一定的难度,解答时要根据所学知识、结合题干信息认真分析解答.


科目:初中化学 来源: 题型:计算题
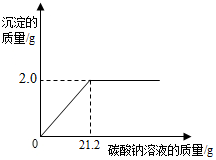 现有一包只含有氯化钙杂质的粗盐样品.某校化学兴趣小组的同学为测定该粗盐样品中氯化钙的质量分数,称取该粗盐样品10g,充分溶解于100g水中,再滴加适量的碳酸钠溶液,产生沉淀的质量与加入碳酸钠溶液的质量关系如图所示.试计算:
现有一包只含有氯化钙杂质的粗盐样品.某校化学兴趣小组的同学为测定该粗盐样品中氯化钙的质量分数,称取该粗盐样品10g,充分溶解于100g水中,再滴加适量的碳酸钠溶液,产生沉淀的质量与加入碳酸钠溶液的质量关系如图所示.试计算:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶于水后显碱性,所以它是一种碱 | |
| B. | 白醋的pH值小于7,所以它呈酸性 | |
| C. | 某物质在20℃时溶解度是30g,所以在20℃时,溶质为30g的该物质的溶液一定是饱和溶液 | |
| D. | 氧化物是指氧元素与另一种化学元素组成的化合物,所以含有氧元素的化合物都是氧化物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 蜡烛燃烧,葡萄酿酒 | B. | 汽车爆胎,石墨变为金刚石 | ||
| C. | 水果腐烂,蔗糖溶解 | D. | 玻璃破碎,鲜肉冷冻 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 蒸发过程中用到的仪器有蒸发皿、酒精灯、玻璃棒、量筒等 | |
| B. | 实验过程中产生的CO2为8.8g | |
| C. | 所用盐酸的质量为200g | |
| D. | 如用10.95%的稀盐酸将m g沉淀溶解,则所用稀盐酸的量与题中的一定量不相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 温度(℃) | 产物 |
| 46.95 | MgCO3•3H2O |
| 47.95 | MgCO3•3H2O |
| 48.95 | MgCO3•3H2O |
| 49.95 | Mg5(OH)2(CO3)4•4H2O |

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 名称 | 新鲜肉 | 次鲜肉 | 变质肉 |
| pH | 5.8~6.2 | 6.3~6.6 | >6.7 |
| A. | 变强 | B. | 变弱 | C. | 不变 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com