

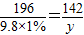
 可知:X%=
可知:X%=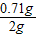 ×100%=3.55%;
×100%=3.55%;

科目:初中化学 来源: 题型:
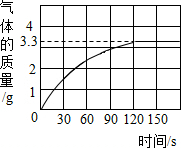 已知某铜矿样品中主要成分是Cu2(OH)2CO3(碱式碳酸铜),Cu2(OH)2CO3(碱式碳酸铜)与稀盐酸反应的化学方程式为:Cu2(OH)2CO3+4HCl═2CuCl2+CO2↑+3H2O.现称取22.2g该铜矿样品放入烧杯中,再加入稀盐酸充分反应,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示(假设铜矿中的杂质不与稀盐酸反应).请根据题意回答问题:
已知某铜矿样品中主要成分是Cu2(OH)2CO3(碱式碳酸铜),Cu2(OH)2CO3(碱式碳酸铜)与稀盐酸反应的化学方程式为:Cu2(OH)2CO3+4HCl═2CuCl2+CO2↑+3H2O.现称取22.2g该铜矿样品放入烧杯中,再加入稀盐酸充分反应,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示(假设铜矿中的杂质不与稀盐酸反应).请根据题意回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:
| 氯气的质量 | 漂白粉的质量 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【例3】工业上常用漂白粉[Ca(ClO2)+CaCl2]与稀硫酸反应放出氯气的质量除以漂白粉的质量所得的百分比(x%)来表示漂白粉的质量优劣。已知漂白粉与稀硫酸的反应化学方程式为:
Ca(ClO2)2+CaCl2+2H2SO4==2CaSO4+2Cl2? +2H2O
现为了测定有一瓶漂白粉的X%,进行了如下实验:称取2克该漂白粉样品,加水溶解配成250毫升溶液。从中取出25毫升该溶液到入一只烧杯中。在该烧杯中加入适量的碘化钾(KI)溶液和过量的稀硫酸,待漂白粉与稀硫酸反应放出的氯气全部和KI反应后,生成I2恰好被31.6克质量分数为1%的硫代硫酸钠(Na2S2O3)溶液消耗完。有关反应式为:
Cl2+2KI==2KCl+I2
2Na2S2O3+I2==Na2S4O6+2NaI
试计算该漂白粉的X%。
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com