
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 解 度 /g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2SO4 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| CaCl2 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| MgCl2 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |



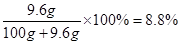 ;(2)根据图示可知,A为硫酸钠;(3)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl是个总反应,涉及到化合反应和复分解反应,碳酸氢钠受热分解的反应属于分解反应,没有涉及到的反应类型是置换反应;(4)二氧化碳在水中的溶解度较小,氨气在水中的溶解度较大,先通氨气可以使水呈碱性,有助于增大二氧化碳的溶解,从而增大了产量;(5)加入稀硝酸和硝酸银能产生白色沉淀,说明有氯离子,可确定纯碱样品含有杂质氯化钠;(6)根据题意,反应分为两步进行,由图可知,盐酸加入质量在50g到100g间时溶液溶质的质量分数变化减小,说明这个过程发生的反应为NaHCO3+HCl= NaCl+H2O+CO2↑,设生成的二氧化碳质量为
;(2)根据图示可知,A为硫酸钠;(3)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl是个总反应,涉及到化合反应和复分解反应,碳酸氢钠受热分解的反应属于分解反应,没有涉及到的反应类型是置换反应;(4)二氧化碳在水中的溶解度较小,氨气在水中的溶解度较大,先通氨气可以使水呈碱性,有助于增大二氧化碳的溶解,从而增大了产量;(5)加入稀硝酸和硝酸银能产生白色沉淀,说明有氯离子,可确定纯碱样品含有杂质氯化钠;(6)根据题意,反应分为两步进行,由图可知,盐酸加入质量在50g到100g间时溶液溶质的质量分数变化减小,说明这个过程发生的反应为NaHCO3+HCl= NaCl+H2O+CO2↑,设生成的二氧化碳质量为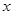 g,总反应方程式为
g,总反应方程式为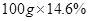
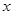
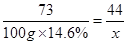 ,解得
,解得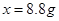 ,所以生成二氧化碳的质量为8.8g;
,所以生成二氧化碳的质量为8.8g;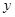 g,有
g,有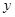
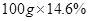
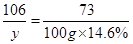 ,解得
,解得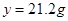
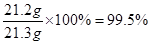


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| | 第1次 | 第2次 | 第3次 | 第4次 |
| 加入稀硫酸的质量/g | 25 | 25 | 25 | 25 |
| 生成氢气的总质量/g | 0.15 | x | 0.4 | 0.4 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
 2H2↑+O2↑),常在水中加入硫酸来增强溶液的导电性,但硫酸本身不发生化学反应。现将溶质的质量分数为10%的稀硫酸90.0 g通电一段时间后停止反应,测得生成氧气为8.0 g,计算:
2H2↑+O2↑),常在水中加入硫酸来增强溶液的导电性,但硫酸本身不发生化学反应。现将溶质的质量分数为10%的稀硫酸90.0 g通电一段时间后停止反应,测得生成氧气为8.0 g,计算: 查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.生成铁的氯化物质量为12.7 g | B.生成铁的氯化物质量为95.0 g |
| C.生成铁的氯化物为FeCl2 | D.生成铁的氯化物为FeCl3 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com