
 如表是元素周期表中的一小部分,其中碳元素的部分信息缺失,下列有关该元素的认识错误的是( )
如表是元素周期表中的一小部分,其中碳元素的部分信息缺失,下列有关该元素的认识错误的是( )| A. | 该元素对应原子的质子数为6 | B. | 该元素属于非金属元素 | ||
| C. | 该元素只能形成一种单质 | D. | 该元素常见的化合价有+2、+4价 |
分析 根据元素周期表中的一个小格所提供的信息和在原子中存在原子序数=核外电子数=质子数的关系,并根据化学元素汉字名称的偏旁可辨别元素的种类,根据原子结构判断化合价.
解答 解:A、碳原子的原子序数为6,则该元素对应原子的质子数为6,说法正确;
B、碳元素的名称为碳,偏旁为“石”,则为非金属元素,说法正确;
C、碳元素组成的单质有金刚石、石墨、无定形碳等多种单质,说法错误;
D、根据原子结构的最外层有4个电子,最高价为+4价,及常见化合物CO,还有+2价,说法正确.
故选C.
点评 本题难度不大,考查学生灵活运用元素周期表中元素的信息、了解元素的简单分类、有机物的特征等进行分析解题的能力.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| A. | 地壳中含量最高的金属元素是铁 | B. | 在空气中铝的抗腐蚀性比铁强 | ||
| C. | 饱和溶液一定比不饱和溶液浓 | D. | 氢氧化钙俗称烧碱 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
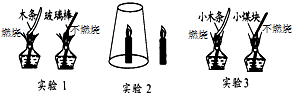 如图是探究物质燃烧条件的3个对比实验:
如图是探究物质燃烧条件的3个对比实验:| 实验1 | 燃烧需要可燃物 |
| 实验2 | 燃烧需要氧气 |
| 实验3 | 温度要达到可燃物的着火点 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 配料 | 精制盐、碘酸钾、抗结剂 |
| 质量等级 | 一级 |
| 含碘量 | (20-30)毫克/千克 |
| 食用方法 | 待食品熟后加入碘盐 |
| 储藏方法 | 密封保存、防潮防热 |
| 分装日期 | 见封口 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 如图是测定空气中氧气含量的实验装置(红磷过量),关于该实验的有关说法,其中正确的是( )
如图是测定空气中氧气含量的实验装置(红磷过量),关于该实验的有关说法,其中正确的是( )| A. | 装置中的红磷也可以换成过量的木炭 | |
| B. | 红磷停止燃烧时应马上打开止水夹,否则会导致压入集气瓶中的水的体积大于集气瓶体积的$\frac{1}{5}$ | |
| C. | 止水夹没有夹紧橡皮管会导致压入集气瓶中的水的体积小于集气瓶体积的$\frac{1}{5}$ | |
| D. | 盛燃烧的红磷的燃烧匙伸入集气瓶后要马上塞紧橡皮塞,否则会导致压入集气瓶中的水的体积大于集气瓶体积的$\frac{1}{5}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com