据统计,每年世界上银总消耗量的40%用于感光材料的生产,感光材料经曝光、显影、定影后,黑白片上的银有80%左右进入定影液,彩色片上的银几乎全部进入废定影液,所以废定影液中银的含量是十分惊人的.某研究性学习小组拟对某照相公司的废定影液进行实验处理,回收其中的银和溴.
(一) 查阅资料可知:
①定影液(硫代硫酸钠,Na
2S
2O
3)跟胶片或相纸上没有感光部分的溴化银反应生成Na
3[Ag(S
2O
3)
2].
②在酸的作用下,Na
3[Ag(S
2O
3)
2]能转化为不溶性的Ag
2S.
③溶液中有少量溴化银,可用锌将其还原出来.
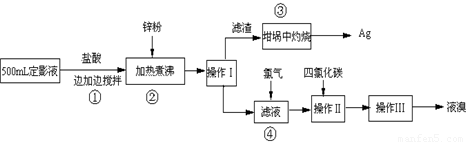
(二) 实验程序设计:

(三) 试回答下列问题:
(1)操作Ⅰ是
过滤
过滤
,移取坩埚可以使用
坩埚钳
坩埚钳
;
(2)步骤③是滤渣中的Ag
2S在氧气中灼烧,除了有银生成外,还有一种气体生成,则化学方程式为
;因此在步骤③之后还应用
氢氧化钠
氢氧化钠
溶液吸收此气体,以防污染空气.
(3)本实验需配制20%的盐酸330mL(密度约为1.0克/毫升),需要30%的浓盐酸(密度为1.1克/毫升)的体积为
200
200
毫升,需要加水的体积为
110
110
毫升;配制时除需量筒、胶头滴管外,还需用的仪器有:
烧杯
烧杯
、
玻璃棒
玻璃棒
.
(4)步骤④中发生的反应是Cl
2+2NaBr═2NaCl+Br
2,此反应属于基本反应类型中的
置换反应
置换反应
反应;溴元素由
-1
-1
价变为
0
0
价;
(5)溴难溶于水,易溶于有机溶剂,四氯化碳属于有机溶剂,化学式为
CCl4
CCl4
,操作Ⅱ中加入四氯化碳的目的
溶解溴
溶解溴
.