
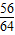 =
=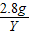
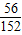 =
=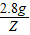
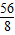 =
=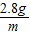


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:课课练 初三化学 三年级全一册·配人教版 题型:020
将质量为4g的铁片放入200g溶质的质量分数为20%的硫酸铜溶液中,片刻后取出铁片,洗涤烘干后称得质量为4.4g,这表明反应中
[ ]
A.析出了0.4g铜
B.有4g铁参加了反应
C.消耗了2.8g铁
D.生成了3.2g铜
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
查看答案和解析>>
科目:初中化学 来源:槐荫区二模 题型:单选题
| A.有5.6g铁参加反应 | B.生成6.4g铜 |
| C.溶液质量减轻0.4g | D.有15.2g硫酸亚铁生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com