
| 氧化钾 | 氧化钙 | 氧化钠 | 氧化镁 | 氧化铝 | 氧化锌 | 氧化铁 | 氧化铜 |
| K2O | CaO | Na2O | MgO | Al2O3 | ZnO | ----- | CuO |


科目:初中化学 来源: 题型:阅读理解
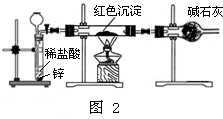 铜及其化合物是工业生产和日常生活中常用的物质,下面是对铜及其化合物的探究.
铜及其化合物是工业生产和日常生活中常用的物质,下面是对铜及其化合物的探究.| 配置用水 | 有浑浊 | 有浑浊 |
| 自来水 | 无浑浊 | 有浑浊 |
| 市售纯净水 | 无浑浊 | 有浑浊 |
| 医用纯净水 | 无浑浊 | 无浑浊 |
| 试验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 饱和溶液 | 2 | 4 | 6 | 8 | 16 | 32 | 128 |
| 现 象 | 白色浑浊→澄清 | ||||||
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论 | |
| 小华的实验 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢分解速率很慢 常温下过氧化氢分解速率很慢 |
装有过氧化氢溶液的试管中加入少量Al2O3 装有过氧化氢溶液的试管中加入少量Al2O3 然后将带火星的木条伸入试管中 然后将带火星的木条伸入试管中 |
木条复燃 | Al2O3能加快H2O2溶液的分解速率 | |
| 小明的实验 | 在一支试管中加入H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管. | 迅速产生大量气泡 迅速产生大量气泡 带火星的木条复燃 带火星的木条复燃 |
FeCl3溶液加快H2O2溶液的分解速率 |
| 实验过程 | 实验现象 | 结论 |
| 向盛有5ml5%的H2O2溶液的试管中加入少量 的HCl,并把带火星的木条伸入试管. |
无明显现象 | Cl-不能催化分解H2O2 Cl-不能催化分解H2O2 |
| 向盛有5ml5%的H2O2溶液的试管中加入少量 的 Fe(NO3)3溶液 Fe(NO3)3溶液 ,并把带火星的木条伸入试管. |
试管中有大量气泡产生,带火星的木条复燃 试管中有大量气泡产生,带火星的木条复燃 |
起催化作用的是Fe3+ 起催化作用的是Fe3+ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 | |
| 小华的实验 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | ______ |
| ______ ______ | 木条复燃 | Al2O3能加快H2O2溶液的分解速率 | |
| 小明的实验 | 在一支试管中加入H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管. | ______ ______ | FeCl3溶液加快H2O2溶液的分解速率 |
| 实验过程 | 实验现象 | 结论 |
| 向盛有5ml5%的H2O2溶液的试管中加入少量 的HCl,并把带火星的木条伸入试管. | 无明显现象 | ______ |
| 向盛有5ml5%的H2O2溶液的试管中加入少量 的______,并把带火星的木条伸入试管. | ______ | ______ |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
由于MnO2和CuSO4溶液都能作H2O2溶液分解的催化剂,某校化学兴趣小组想探究其他一些金属氧化物和盐溶液是否也可以作H2O2溶液分解的催化剂?请你参与他们的探究过程。
(1)[小华的猜想]:Al2O3能作过氧化氢分解的催化剂。
[小明的猜想]:FeCl3溶液能作过氧化氢分解的催化剂。
(2)[实验验证]:
| 实验步骤 | 实验现象 | 实验结论 | |
| 小华的实验 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 |
|
|
| 木条复燃 | Al2O3能加快H2O2溶液的分解速率 | |
| 小明的实验 | 在一支试管中加入H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管。 |
| FeCl3溶液加快H2O2溶液的分解速率 |
(3)[结论]:故Al2O3、FeCl3溶液能作H2O2溶液分解的催化剂。
(4)[反思1]:有的同学认为小华的实验,不能完全证明Al2O3在H2O2溶液分解中起了催化作用。还应补充再探究Al2O3 。
[反思2]:已知FeCl3在水中可解离出Fe3+ 和Cl-,同学们提出以下猜想:
甲同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的H2O;
乙同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的Fe3+;
丙同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的Cl-;
你认为最不可能的是 同学的猜想, 理由是
(5)同学们对余下的两个猜想,用实验进行了探究。请你仔细分析后填表:
| 实验过程 | 实验现象 | 结论 |
| 向盛有5ml5%的H2O2溶液的试管中加入少量 的HCl,并把带火星的木条伸入试管。 | 无明显现象 |
|
| 向盛有5ml5%的H2O2溶液的试管中加入少量 的 ,并把带火星的木条伸入试管。 |
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com