
【题目】实验室常用下图所示的装置制取气体和气体性质的验证,请回答:
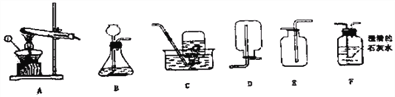
(1)仪器①的名称___________。
(2)实验室用高锰酸钾制取氧气,可选取的收集装置是_______(填序号),发生反应的化学方程式是__________________________________。
(3)某同学利用石灰石和盐酸通过装置B、F来验证二氧化碳的性质,实验过程中观察到F中有气泡冒出,澄清的石灰水未变浑浊,试分析其可能的原因______。
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:初中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿空气中易变质。CuCl的制备流程如下:
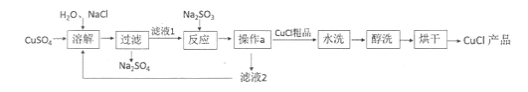
(1)“滤液1”中除了Na+、SO42-外,还存在较多的离子是 、 (写离子符号)
(2)“反应”中发生的化学变化是2CuCl2+Na2SO3=2CuCl↓+2NaCl+SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为 。
(3)“操作a”的名称是 。本流程中可以循环利用的物质(水除外)是 。(写化学式)
(4)可用“水洗”的原因是 ,“醇洗”的目的是 。
(5)160g CuSO4与足量NaCl经上述制备流程,可生成的CuCl最多是 g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等。某工厂以石灰石为原料生产氯化钙晶体的流程如下。原料石灰石中含有杂质主要是MgCO3、MgSO4 和Al2O3。
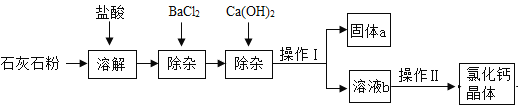
⑴石灰石粉溶解时,Al2O3发生反应的化学方程式为________________。
⑵加入BaCl2除去的杂质离子是____________(填离子符号);
⑶操作Ⅰ的名称为____________,需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、____________。操作Ⅱ的具体步骤为:____________、冷却结晶。
⑷固体a的成分一定含有________________________(只写一种)。检验溶液b的酸碱性,如果显碱性,还需加入适量的____________ (填化学式)提高产品纯度。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】微观示意图可以形象的表示物质发生的微观变化
(1)请在下图第一、三方框中把硫化氢在氧气中燃烧(2H2S+3O2![]() 2SO2+2H2O)的微观示意图补画完整。______________
2SO2+2H2O)的微观示意图补画完整。______________
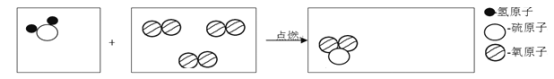
(2)在上述化学反应中,化合价不发生改变的元素是_________(填符号)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定铜锌合金中锌的质量分数,进行了以下实验;取40g铜锌合金放入烧杯中,称得烧杯及所盛铜锌合金的总质量为140g,再把120g盐酸平均分成四份依次加入烧杯中,每次充分反应后进行称量,实验数据如下:
所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
烧杯及所盛物质的总质量/g | 169.7 | 199.4 | 229.2 | 259.2 |
请你据此分析计算:
(1)第一次实验生成氢气的质量是 ________ g.
(2)利用第一次实验的数据,计算30g盐酸中溶质的质量分数________ (写出计算过程,精确到0.1%)
(3)实验最终结束后,同学们求出了合金中锌的质量分数=__________.
(4)下图表示所加盐酸的质量与反应后所得溶液质量的关系曲线,请写出A点(X=______ ,Y=______)的坐标。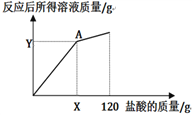
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据下图回答问题:
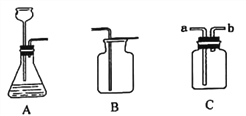
(1)若用装置C收集氧气,气体从___________(填“a”或“b”)端通入。
(2)若选用装置A、B和C制取并收集干燥的二氧化碳,则需将装置A中的错误改正为________,装置C中应盛放的液体试剂为_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用下列各组物质不能验证Fe、Cu、Ag三种金属活动性顺序的是![]()
A. Cu、![]() 溶液、
溶液、![]() 溶液 B. Fe、Cu、Ag、稀盐酸
溶液 B. Fe、Cu、Ag、稀盐酸
C. Fe、Ag、![]() 溶液 D. Fe、Cu、稀硫酸、
溶液 D. Fe、Cu、稀硫酸、![]() 溶液
溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国化学家侯德榜(如图)改革国外的纯碱生产工艺,生产流程可简要表示如下:


(1)上述生产纯碱的方法称____________________,副产品的一种用途为_________________。
(2)向沉淀池中通入两种气体,先通入的是________________(填“NH3”或“CO2”),沉淀池发生的化学反应方程式是_______________________________。
(3)写出上述流程中X物质的化学式_____________________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了_____________(填“循环I”或“循环II”)。从沉淀池中取出NaHCO3沉淀的操作是__________________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,先滴加足量的_______,排除Na2CO3的干扰,再滴加___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种固体物质的溶解度曲线如下图所示。回答:
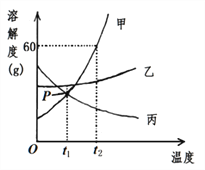
(1)P点表示的意义是:__________;
(2)分别将三种物质的饱和溶液从t2 ℃降至t1 ℃,所得溶液中溶质的质量分数由大到小的顺序是:____;
(3)欲从含少量乙的甲中分离提纯甲,应采用的方法是:______;
(4)t2 ℃时,将50 g甲放入50 g水中,所得溶液的质量是__________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com