

分析 (1)根据加入硝酸和硝酸银得到白色沉淀,结合质量守恒定律分析判断;
(2)根据现象和加入的试剂写书化学方程式;
(3)加入稀硫酸得到黄色溶液,可推得应该是生成了硫酸铁,进而书写硫酸铁和氢氧化钠反应的化学方程式;
(4)进而前三步分析对应的物质病书写化学方程式;
(5)根据质量守恒定律可知,过程中质量的减少是因为生成了氢气,所以可以求算氢气的质量,根据氢气的质量和对应的化学方程式求算硫酸以及生成的硫酸亚铁和参加反应的铁的质量,进而求算对应的质量分数.
解答 解:由步骤②生成不溶于硝酸的沉淀的实验现象和加入的试剂为硝酸银,可推得该溶液中有氯离子,根据质量守恒定律可知甲班同学所用的制取氧气的固体为氯酸钾.步骤②是氯化钾和硝酸银反应生成氯化银和硝酸钾,对应的化学方程式为AgNO3+KCl=KNO3+AgCl↓.
步骤④加入足量的稀硫酸得到黄色溶液,可知该黄色溶液为硫酸铁,此时加入氢氧化钠,氢氧化钠和硫酸铁反应生成氢氧化铁和硫酸钠,对应的化学方程式为Fe2(SO4)3+6NaOH=2Fe(OH)3↓+3Na2SO4.同时可推得原混合物中含有氧化铁,由于是还原金属氧化物实验所得,根据③中固体在空气中灼烧得到能够使澄清石灰水变浑浊的气体,所以所用还原剂为木炭.而氯酸钾制取氧气需要用到二氧化锰做催化剂,所以最后和足量稀硫酸反应后剩余的固体为二氧化锰.
故(1)~(4)答案为:
(1)KClO3;
(2)AgNO3+KCl=KNO3+AgCl↓;
(3)Fe2(SO4)3+6NaOH=2Fe(OH)3↓+3Na2SO4.
(4)碳、氧化铁和二氧化锰; 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑和3C+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2↑;
(5)质量守恒定律可知,生成的氢气的质量为50.2g+11.8g-61.9g=0.1g
设参加反应的铁的质量为x,反应的稀硫酸中溶质的质量为y,生成的硫酸亚铁的质量为z.
Fe+H2SO4=FeSO4+H2↑
56 98 152 2
x y z 0.1g
$\frac{56}{x}$=$\frac{98}{y}$=$\frac{152}{z}$=$\frac{2}{0.1g}$
x=2.8g
y=4.9g
z=7.6g
该硫酸溶液中溶质的质量分数为$\frac{4.9g}{50.2g-16.4g}$×100%≈14.5%
所得溶液中溶质的质量分数为$\frac{7.6g}{61.9g-16.4g-(11.8g-2.8g)}$×100%≈20.8%
答:①反应后产生气体的质量为0.1g
②该硫酸溶液中溶质的质量分数为14.5%
③所得溶液中溶质的质量分数为20.8%
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


 科学实验活动册系列答案
科学实验活动册系列答案科目:初中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将燃着的木条伸入某气体中 | 木条熄灭 | 该气体一定是二氧化碳 |
| B | 将A在空气中点燃,罩上干冷的烧杯 | 烧杯内壁有水珠 | A中一定含氢、氧元素 |
| C | 向某溶液中滴入稀盐酸 | 有气泡产生 | 该物质一定含CO32- |
| D | 向某溶液中滴入无色酚酞试液 | 无色酚酞试液不变色 | 无色溶液不一定是酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CoCO3+O2$\frac{\underline{\;强热\;}}{\;}$CoCO2+CO2 | B. | 2CoCO3+O2$\frac{\underline{\;强热\;}}{\;}$2CoCO2+2CO2 | ||
| C. | 4CoCO3+O2$\frac{\underline{\;强热\;}}{\;}$2Co2O3+4CO2 | D. | 4CoCO2+3O2$\frac{\underline{\;强热\;}}{\;}$2Co2O3+4CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 性质 | 用途 |
| A | 氢氧化钙溶液呈碱性 | 改良酸性土壤 |
| B | 稀盐酸能与某些金属氧化物反应 | 除铁锈 |
| C | 浓硫酸具有脱水性 | 实验室干燥气体 |
| D | 氢氧化钠能与某些非金属氧化物反应 | 吸收二氧化硫 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:推断题
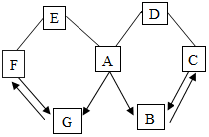 如图所示A~G是初中化学中常见的物质.图中“→”表示转化关系,“-”表示相互能反应.已知A时人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F都是氧化物,D为红色粉末.请回答:
如图所示A~G是初中化学中常见的物质.图中“→”表示转化关系,“-”表示相互能反应.已知A时人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F都是氧化物,D为红色粉末.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 打开盛有浓硫酸的试剂瓶塞,瓶口出现白雾 | |
| B. | 浓硫酸不慎沾到皮肤上,立即用大量的水冲洗,然后再涂上3%-5%的氢氧化钠溶液 | |
| C. | 实验室用稀硫酸和块状石灰石制取二氧化碳 | |
| D. | 硫酸可用于生产化肥、农药、染料以及冶炼金属等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com