

分析 (1)根据钡离子的验证方法判断BaCl2溶液是否已过量;
(2)干燥后的滤渣为硫酸钡,依据硫元素守恒计算硫化亚铁质量分数;
(3)黄铁矿中会含有其它金属杂质时,与王水反应生成的盐的质量增加,再加入足量的氢氧化钠溶液时,生成的沉淀的质量增加,据此进行分析解答.
解答 解:(1)如果入BaCl2溶液已过量,则溶液中会出现钡离子,可以取上层清液少量于试管,滴加稀硫酸,若产生白色沉淀,则BaCl2溶液已过量;
(2)利用关系式法计算:
FeS2~2BaSO4
120 466
m 2.33g
$\frac{120}{m}=\frac{466}{2.33g}$
m=0.6g,
则该矿石中FeS2的质量分数是$\frac{0.6g}{2g}$×100%=30%,
(3)黄铁矿中会含有其它金属杂质时,与王水反应生成的盐的质量增加,再加入足量的氢氧化钠溶液时,生成的沉淀的质量增加,测定结果会偏高.
故答案为:(1)取上层清液少量于试管,滴加稀硫酸,若产生白色沉淀,则BaCl2溶液已过量;
(2)30%;(3)偏高.
点评 本题难度不是很大,考查同学们新信息获取、处理及灵活运用所学知识分析问题、解决问题的能力.


科目:初中化学 来源: 题型:选择题
| A. | 酚酞中碳、氢、氧三种元素的质量比为20:14:4 | |
| B. | 酚酞的额相对分子质量为138 | |
| C. | 酚酞中氧元素的质量分数最小 | |
| D. | 酚酞不是氧化物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁丝在氧气中燃烧,火星四射,生成黑色固体,放出大量的热 | |
| B. | 磷在氧气中燃烧,产生大量的白色烟雾 | |
| C. | 木炭在氧气中燃烧,发出蓝色火焰,产生大量白烟 | |
| D. | 硫在空气中燃烧,生成无色的二氧化硫气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 用红磷测定空气中氧气含量实验时,小明同学觉得教材的实验存在不足,他通过反思后,提出了改进方法(如图所示),你认为改进后的优点是:装置始终密封,操作简便,没有污染、提高了测定数据的准确度.
用红磷测定空气中氧气含量实验时,小明同学觉得教材的实验存在不足,他通过反思后,提出了改进方法(如图所示),你认为改进后的优点是:装置始终密封,操作简便,没有污染、提高了测定数据的准确度.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
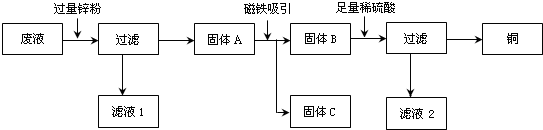
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com