
| A、所含硫原子的物质的量之比为1:1 |
| B、氧原子的物质的量之比为3:2 |
| C、氧元素的质量比为2:3 |
| D、硫元素的质量比为5:4 |
| 1g |
| 64g/mol |
| 1g |
| 80g/mol |
| 1g |
| 64g/mol |
| 1g |
| 80g/mol |
| 1g |
| 64g/mol |
| 1g |
| 80g/mol |
| 1g |
| 64g/mol |
| 1g |
| 80g/mol |


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
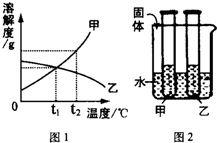 如图1是甲、乙两种固体物质的溶解曲线,如图2是盛水的烧杯中放着t2℃下甲、乙两种物质饱和溶液的试管(不考虑溶剂的蒸发),根据图象和有关信息判断,下列说法中错误的是( )
如图1是甲、乙两种固体物质的溶解曲线,如图2是盛水的烧杯中放着t2℃下甲、乙两种物质饱和溶液的试管(不考虑溶剂的蒸发),根据图象和有关信息判断,下列说法中错误的是( )| A、t2℃时,甲、乙两种物质的饱和溶液中溶质的质量分数大小关系为:甲>乙 |
| B、将甲、乙两种物质的饱和溶液都从t2℃降至将甲、乙两种物质的饱和溶液都从t2℃降至t1℃时,两种溶液中溶质的质量分数相等时,两种溶液中溶质的质量分数相等 |
| C、向烧杯的水中加NaOH固体后,只有乙溶液中溶质的质量分数变小 |
| D、向烧杯的水加NH4NO3固体后,只有盛放甲溶液的试管中有晶体析出 |
查看答案和解析>>
科目:初中化学 来源: 题型:
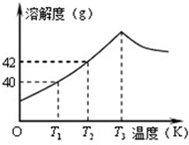 如图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4?10H2O)在温度为T3K时开始分解为无水硫酸钠.现有142g温度为T2 K的饱和硫酸钠溶液,当温度降为T1K或升为T4K(T4>T3)时析出晶体的质量相等,则温度为T4K时Na2SO4的溶解度为( )
如图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4?10H2O)在温度为T3K时开始分解为无水硫酸钠.现有142g温度为T2 K的饱和硫酸钠溶液,当温度降为T1K或升为T4K(T4>T3)时析出晶体的质量相等,则温度为T4K时Na2SO4的溶解度为( )| A、小于40g |
| B、等于40g |
| C、等于42g |
| D、大于42g |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、氯化钠 氯化钙 |
| B、硝酸钙 硝酸镁 |
| C、氯化钠 熟石灰 |
| D、氯化钙 醋酸镁 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、复分解反应的反应物都是化合物 |
| B、化合反应的反应物中必定有单质 |
| C、分解反应的生成物中必定有单质 |
| D、置换反应的反应物中必定有金属单质 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 化学方程式 | 现 象 | 用 途 | |
| (1)与金属 | |||
| (2)与碱 | |||
| (3)与盐 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com