
【题目】金属的用途与性质密切相关。
(1)图1所示赤铁矿的主要成分是_______(填化学式)。
(2)沿江铁路的建成,使常熟市民的出行更为方便。铁路建设需要大量的钢铁,在炼铁高炉中将赤铁矿还原为铁的主要化学方程式是___________。
(3)家用电线常用铜制,但在高压远距离输电中,常用铝代替铜,请根据图2的信息分析,其原因是__________。
(4)在空气中,铝具有很好的抗腐蚀性,其原因用化学方程式表示为_______。
(5)新能源汽车越来越受到人们的青睐,华晨宝马530Le新能源汽车定位系统微电脑控制器应用了一种新型材料氮化铝( AlN)。工业上在氮气流中由氧化铝与焦炭在高温条件下制得氮化铝,并生成一种可燃性气体,该反应的化学方程式为____。
(6)为探究铁、铜的金属活动性,分别将铁丝、铜丝插入稀硫酸中(图3所示),说明铁比铜的金属活动性更强的实验现象是______,反应的化学方程式是____。
【答案】![]()
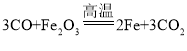 铝的密度比铜小,铝元素在地壳中的含量比铜元素高
铝的密度比铜小,铝元素在地壳中的含量比铜元素高 ![]()
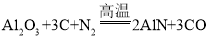 铁丝表面产生气泡,溶液变为浅绿色,铜丝表面无明显现象
铁丝表面产生气泡,溶液变为浅绿色,铜丝表面无明显现象 ![]()
【解析】
(1)赤铁矿的主要成分是三氧化二铁,化学式为![]() 。
。
(2)由题意在炼铁高炉中将赤铁矿还原为铁的主要反应为一氧化碳和三氧化二铁在高温条件下反应生成铁和二氧化碳,反应的化学方程式是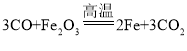 。
。
(3)家用电线常用铜制,但在高压远距离输电中,常用铝代替铜,根据图2的信息可知,其原因是铝的密度比铜小,铝元素在地壳中的含量比铜元素高。
(4)在空气中,铝具有很好的抗腐蚀性,是因为常温下铝与氧气反应生成三氧化二铝,在金属铝的表面形成了一层致密的氧化物薄膜,反应的化学方程式表示为![]() 。
。
(5)由题意工业上在氮气流中由氧化铝与焦炭在高温条件下制得氮化铝(AlN),并生成一种可燃性气体,根据质量守恒定律可知该气体由碳元素和氧元素组成,且具有可燃性,该气体为一氧化碳,故该反应的化学方程式为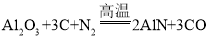 。
。
(6)如图3所示,为探究铁、铜的金属活动性,分别将铁丝、铜丝插入稀硫酸中,观察到铁丝表面产生气泡,溶液变为浅绿色,铜丝表面无明显现象,说明铁能与稀硫酸反应而铜不能与稀硫酸反应,则有铁比铜的金属活动性更强,铁与稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式是![]() 。
。


 智能训练练测考系列答案
智能训练练测考系列答案科目:初中化学 来源: 题型:
【题目】在宏观、微观和符号之间建立联系是化学学科的特点。高温下,甲和乙反应生成丙和丁,结合表中信息判断下列说法正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
|
化学式 | ? | C | CO | H2 | |
微观 示意图 |
|
|
| ? |
A. 甲的化学式为CO2 B. 保持丙化学性质的最小粒子为碳原子和氧原子
C. 反应物和生成物中都有化合物 D. 反应生成丙与丁的分子个数比为2:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】锂矿是重要的国家战略资源,有着21世纪改变世界格局的“白色石油”和“绿色能源金属”之称。2019年诺贝尔化学奖颁给了研究锂离子电池的科学家。如图是锂原子结构示意图和在元素周期表中的相关信息,据此回答下列问题。
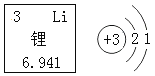
(1)锂元素属于_________(填“金属”或“非金属”)元素。
(2)10—18号元素中________(填元素符号)的化学性质与锂元素相似。
(3)标出氧化锂中锂元素的化合价________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C三种物质的溶解度曲线如图所示,请回答下列问题:
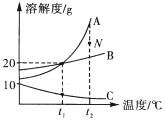
(1)N点对应的是物质A的______________(“饱和”或“不饱和”)溶液。
(2)加热C的饱和溶液,出现浑浊现象,其原因是________________。
(3)除去A中少量的B,步骤是:加水溶解,蒸发浓缩,________,过滤,洗涤,干燥。
(4)t1℃时,将A、B、C各8 g分别加入盛有50g水的烧杯中, 充分溶解,测得三种溶液中溶质的质量分数分别为w(A) 、w(B) 、w(C),则三者之间的大小关系是______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组同学进行如下实验探究。
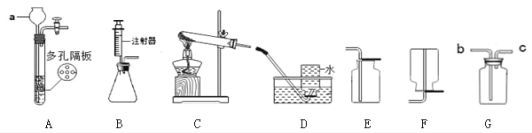
(1)仪器a的名称________。
(2)实验室用氯酸钾和二氧化锰的混合物制取氧气,化学方程式为________,选用的装置组合可以是________。
(3)实验室制取二氧化碳的化学方程式是________,若用 G 装置收集二氧化碳,气体应 从________端进入(填“b”或“c”),检验二氧化碳收集满的方法是________。
(4)用锌粒和稀硫酸制取氢气时,与装置B相比,装置A的优点是________。
(5)兴趣小组同学准备探究制取氧气的适宜催化剂,实验方案如下:
Ⅰ.用 MnO2、CuO、Fe2O3、Cr2O3 四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
Ⅱ.取30粒含MnO2的海藻酸钠微球,采用图2装置进行实验。改用其他三种微球,分别 重复上述实验,得到图3的锥形瓶内压强随时间变化的曲线图。
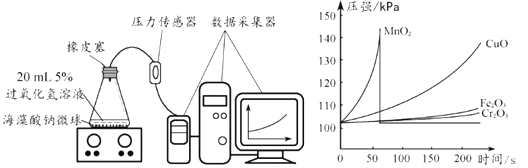
① 每次实验时,海藻酸钠微球数应相同的原因________。
② 用含MnO2的海藻酸钠微球进行实验,60S时压强瞬间回落,其原因是________。
③ 从实验曲线看,催化效果较好、反应温和的催化剂是________。
④CuO、Fe2O3、Cr2O3 对应的曲线最终________(填“不重合或“重合”) 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是钇元素在元素周期表中的信息和氧离子结构示意图。下列说法正确的是( )
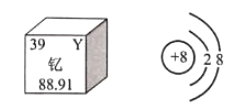
A.钇原子中的质子数为88.91
B.钇原子中的中子数为39
C.氧离子的符号为O2+
D.氧离子已达到相对稳定结构
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2020年3月22-28日是“中国水周”,其主题为“坚持节水优先,建设幸福河湖”。爱护水资源人人有责,我们应该了解一些有关水的知识。请回答:
(1)下列“水”属于纯净物的是___________(填序号)。
a.蒸馏水
b.河水
c.自来水
d.矿泉水
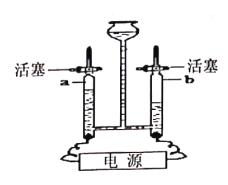
(2)用如图甲装置进行电解水的实验,a中收集到的气体是________(填名称), 该实验说明水是由_________组成的。
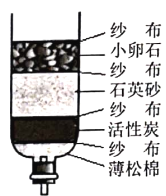
(3)云南水资源丰富,但分布不均,有些村民用地下水作为生活用水,人们常用_____________检验地下水是硬水还是软水;生活中可用_________的方法降低水的硬度;某同学自制如图乙所示简易净水器,图中活性炭的主要作用是________________。纱布、小卵石、石英沙的作用是_______________。
(4)请举一例节约用水的具体措施:________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸氢铵是一种常用的化肥,小组同学对碳酸氢铵进行相关的探究:
[查阅资料] (1)碳酸氢铵是一种白色粒状晶体,有氨味,易溶于水。
(2)氨气具有刺激性气味,极易溶于水,能使湿润的红色石蕊试纸变蓝。
[提出问题]碳酸氢铵有哪些化学性质?
[作出猜想]猜想一:碳酸氢铵能与酸反应;
猜想二:碳酸氢铵能与碱反应;
猜想三:碳酸氢铵易分解。
[设计与实验]
实验操作 | 实验现象 | 实验结论 | |
1 | ______ | 有气泡产生 | 猜想一正确 |
2 | 取少量碳酸氢铵样 品与熟石灰混合研磨 | ____ | 猜想二正确 |
3 |
| 红色石蕊试纸变蓝,澄清石灰水变浑浊 | 猜想三正确,B中发生反应的化学方程式 为____ |
[反思] (1)实验3中向水中加入氧化钙的目的是_______。
(2)有同学对实验2的结论提出质疑:碳酸氢铵易分解产生有刺激性气味的气体,研磨会使温度升高,能加快碳酸氢铵分解,所以实验2的结论不严谨。
[补充探究]有同学为了进一步验证猜想二,进行如下实验:
实验操作 | 实验现象 |
①将碳酸氢铵溶液加入到氢氧化钙溶液中 | 有白色沉淀生成,但没有气体逸出 |
②将碳酸氢铵溶液加入到氢氧化钠溶液中 | 有刺激性气味的气体生成 |
[分析]根据常见酸、碱、盐的溶解性分析,①实验中生成的白色沉淀是____,实验中没有气体逸出可能的原因是_______。
[实验结论]三个猜想均正确。
[拓展应用]保存或使用碳酸氢铵时,需注意_______(写出一点)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水和溶液在生产、生活中起着十分重要的作用,请回答下列问题。
(1)①自然界中的水都不是纯水,通过过滤可除去水中的_________ (填“不溶性”或“可溶性”)杂质。
② 热水瓶用久后,瓶胆内壁常附着一层水垢(主要成分是CaCO3和Mg(OH)2),可用稀盐酸来洗涤。写出盐酸与Mg(OH)2反应的化学方程式_____________________。
③ 某熟石灰久置于空气中,部分变质生成了碳酸钙,取l0g该熟石灰样品与足量的稀盐酸 充分反应后,生成l.lg二氧化碳,则l0g该样品中氢氧化钙的质量分数为多少?(请写出计算过程)_____
(2)如图是硝酸钾和氯化钠的溶解度曲线,回答下列问题。
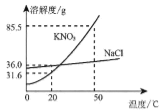
① 在50℃时,硝酸钾的溶解度是85.5g。这句话的含义是_______________。
② 20℃时,若从氯化钠和硝酸钾两种物质的饱和溶液中析出等质量的固体,须恒温蒸发掉较多水的是_________ (填“氯化钠”或“硝酸钾”)的饱和溶液。
③ 20℃时,在进行“粗盐中难溶性杂质的去除”实验过程中,如要溶解8g粗盐(粗盐中氯化钠含量约为80%)应选择_________ (填“l0mL”、“20mL”或“50mL”)规格的量筒,量取所需要的水最为合适。
④ 实验室用氯化钠固体配制50gl5%的氯化钠溶液,在溶解过程中,玻璃棒的作用是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com