
某氢氧化钠样品中含有少量的碳酸钠杂质.现取21.3g样品于烧杯中,加入173.4g水使其完全溶解,再向其中逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示,请计算:
(1)样品中氢氧化钠的质量.
(2)B点时,烧杯内溶液的溶质质量分数.

【答案】 (1)16g;(2)10%
【解析】
试题分析: (1)设样品中含有碳酸钠杂质的质量是X,碳酸钠与盐酸反应生成氯化钠的质量为y,
(1)设样品中含有碳酸钠杂质的质量是X,碳酸钠与盐酸反应生成氯化钠的质量为y,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
X y 2.2g
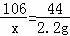 ,
,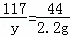
x=5.3g y=5.85g;
样品中氢氧化钠的质量:21.3g﹣5.3g=16g;
(2)B点是盐酸与氢氧化钠以及碳酸钠恰好完全反应,溶液中的溶质只有氯化钠;
设,氢氧化钠与盐酸反应生成的氯化钠的质量为z,
NaOH+HCl═NaCl+H2O
40 58.5
 16g z
16g z
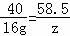
z=23.4g
B点时,烧杯内溶液的溶质质量分数: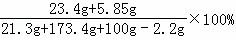 =10%,
=10%,
答:(1)样品中氢氧化钠 的质量16g;
的质量16g;
(2)B点时,烧杯内溶液的溶质质量分数10%.
考点: 根据化学方程式的书写


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:初中化学 来源: 题型:
下图是“×××”补钙剂商品标签图。我能根据标签信息完成下列问题:
| ×××牌钙片 |
| 【主要成分】碳酸钙、维生素D 【功效】补钙 【规格】2.0g/片 每片中含:碳酸钙≥1.0g 维生素D 100IU 【注意事项】本品不能代替药物,不宜超过推荐量 |
小林同学为测定其碳酸钙的含量标注是否属实,他取出6片片剂,研碎后放入烧杯中,逐滴加入稀盐酸,至不 再放出气体为止,共用去盐酸40.0g,称量烧杯中剩余物质的质量为49.
再放出气体为止,共用去盐酸40.0g,称量烧杯中剩余物质的质量为49. 8 g(不含烧杯质量,假定钙片其他成分不与盐酸反应),请求出:
8 g(不含烧杯质量,假定钙片其他成分不与盐酸反应),请求出:
①生成二氧化碳的质 量 g。
量 g。
②稀盐酸中溶质的质量分数。(精确到小数点后一位)
③通过计算判断钙片中碳酸钙的含量标注是否属实。
查看答案和解析>>
科目:初中化学 来源: 题型:

高纯氧化钙是用于电子工业重要的无机化工原料。用硝酸钙溶液制备高纯氧化钙的工艺流程如下:
下列说法不正确的是
A.过滤后所得沉淀表面一定含有的可溶性杂质是NH4NO3
B.冷却需在干燥的环境中进行,否则制得的高纯氧化钙中会混有杂质Ca(OH)2
C.制备高纯氧化钙的工艺流程中生成的沉淀是CaCO3
D.该工艺流程中可以循环使用的物质有NH4NO3和CO2
查看答案和解析>>
科目:初中化学 来源: 题型:
金属钠投入到NH4Cl溶液中,钠浮在液面上,熔成小球,四处游动,并生成大量气体。为确定气体的成分,进行下列实验探究。
(1)猜想:气体可能是HCl、NH3、H2中的一种或几种,作此猜想的理论依据是 ▲ 。
(2)实验:甲同学为判断气体成分,查阅资料得知:2NH3+3CuO △ 3Cu+N2+3H2O。
于是设计了如下图实验装置:

(3)现象与结论:A中观察到酚酞试剂变红色,证明有 ▲ ;B中玻璃管内观察到固体表面由黑色变红色,证明有 ▲ 。
(4)实验反思:①浓硫酸的作用是 ▲ 。
②乙同学认为甲的设计不能确定是否含有HCl,于是他将气体通入酸化的 ▲ 溶液中,无白色沉 淀产生,则该气体中 ▲ HCl(填“有”或“无”)。
淀产生,则该气体中 ▲ HCl(填“有”或“无”)。
③写出Na与NH4Cl溶液反应的化学方程式 ▲ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
某校化学兴趣小组用一瓶含有少量氯化钠的硫酸钠固体样品,进行如图所示的实验

请跟据以上信息计算(结果保留到小数点后两位)
(1)反应生成沉淀的质量为 g。
(2)样品中硫酸钠的质量。
(3)求滤液中氯化钠的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
根据右图的信息判断,下列说法错误的是
 A.硫元素属于非金属元素
A.硫元素属于非金属元素
B.硫原子的核电荷数为16
C.硫原子的相对原子质量为32.07 g
D.硫离子的最外层电子数为6
查看答案和解析>>
科目:初中化学 来源: 题型:
物质的名称、俗名、化学式完全一致的是 ( )
A.碳酸钠 纯碱 Na2CO3 B.氯化钠 粗盐 NaCl
C.氧化钙 熟石灰 CaO D.硫酸铜 胆矾 CuSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com