


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g) |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.2 |
| KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 | |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 河段编号 | 水质类别 | 主要污染指标 | 质量状况 |
| 甲 | Ⅱ | 良好 | |
| 乙 | Ⅳ | 汞 | 一般 |
| 丙 | 劣Ⅴ | 总磷、氨(NH3)氮等 | 较差 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
下表是NaCl和KCl的溶解度数据,请回答下列问题。
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g) | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.2 |
| KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 |
(1)40℃时,氯化钠的溶解度是 g。
(2)将80℃时, 同质量的NaCl和KCl的饱和溶液,分别冷却到0℃,析出晶体最多的是_ (填“NaCl”或“KCl”)溶液。
(3)20℃时,向两只分别盛有35 g NaCl和KCl固体的烧杯中,各加入100g水,充分溶解后,能形成饱和溶液的物质是 ,其溶液的溶质质量分数是______(精确到0.1%)。
(4)温度不变的情况下,若要将接近饱和的KCl溶液变成饱和溶液,可采用的方法是_______________。(写一种)
 Ⅱ.(6分)阅读下列三段材料,回答问题:
Ⅱ.(6分)阅读下列三段材料,回答问题:
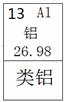
材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(右表是其片断),并在他的元素周期表中留下了许多空位代表尚未发现的新元素,其中就预言了“类铝”这种新元素。
 材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g·cm-3,能与水剧烈反应生成氢气和氢氧化镓。不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0 g·cm-3之间。
材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g·cm-3,能与水剧烈反应生成氢气和氢氧化镓。不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0 g·cm-3之间。
材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为
5.94g·cm-3,从而验证了元素周期表的正确性。随后科学家根据元素
周期表的空位,按图索骥,发现了许多新元素。目前金属镓广泛用于
制造半导体材料。镓的原子结构示意图如右图所示。
(1)镓元素的质子数为__________,其氯化物的化学式为_____________。
(2)请根据上述材料,小结金属镓的有关知识:
① 物理性质:镓是银白色金属,密度为5.94g·cm -3
-3
② 化学性质(请用化学方程式表示):_____________________________________;
③ 用途:____________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
下表是NaCl和KCl的溶解度数据,请回答下列问题。
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g) | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.2 |
| KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 |
(1)40℃时,氯化钠的溶解度是 g。
(2)将80℃时, 同质量的NaCl和KCl的饱和溶液,分别冷却到0℃,析出晶体最多的是_ (填“NaCl”或“KCl”)溶液。
(3)20℃时,向两只分别盛有35 g NaCl和KCl固体的烧杯中,各加入100g水,充分溶解后,能形成饱和溶液的物质是 ,其溶液的溶质质量分数是______(精确到0.1%)。
(4)温度不变的情况下,若要将接近饱和的KCl溶液变成饱和溶液,可采用的方法是_____
___________。(写一种)
 Ⅱ.(6分)阅读下列三段材料,回答问题:
Ⅱ.(6分)阅读下列三段材料,回答问题:
材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(右表是其片断),并在他的元素周期表中留下了许多空位代表尚未发现的新元素,其中就预言了“类铝”这种新元素。
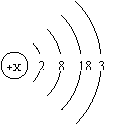 材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g·cm-3,能与水剧烈反应生成氢气和氢氧化镓。不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0 g·cm-3之间。
材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g·cm-3,能与水剧烈反应生成氢气和氢氧化镓。不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0 g·cm-3之间。
材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为
5.94g·cm-3,从而验证了元素周期表的正确性。随后科学家根据元素
周期表的空位,按图索骥,发现了许多新元素。目前金属镓广泛用于
制造半导体材料。镓的原子结构示意图如右图所示。
(1)镓元素的质子数为__________,其氯化物的化学式为_____________。
(2)请根据上述材料,小结金属镓的有关知识:
① 物理性质:镓是银白色金属,密度为5.94g·c m-3
m-3
② 化学性质(请用化学方程式表示):_____________________________________;
③ 用途:____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com