


| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 带火星的木条复燃 | | 溶液中有气泡放出 | 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中有气泡放出 带火星的木条复燃 | 固体质量仍为0.2g | 溶液中有气泡放出 带火星的小木条复燃 | 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中有气泡放出 带火星的木条复燃 | 固体质量仍为0.2g | 溶液中有气泡放出 带火星的小木条复燃 | 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
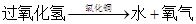 ;
;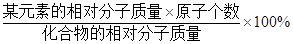 )计算.
)计算.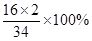 =54×
=54×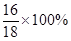


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:初中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
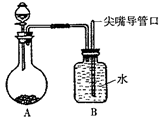
| A.二氧化碳和石灰水 |
| B.石灰石和稀盐酸 |
| C.二氧化锰和过氧化氢溶液 |
| D.二氧化硫和高锰酸钾溶液 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

| 实验步骤及操作方法 | 预期的实验现象 | 结论 |
| ① 取少量过氧化钙放入试管中,加足量水,振荡, ② 。 | ① 产生气泡, ② 。 | 过氧化钙和水反应产生的另一种物质是氢氧化钙 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
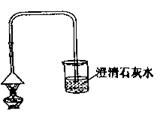
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.假设 | B.实验 | C.观察 | D.做出结论 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题


| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中 , 带火星的木条复燃。 | | 溶液中有气泡放出, 。 | 猜想Ⅰ、Ⅱ不成立,猜想Ⅲ成立。 |


查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
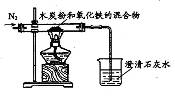
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com